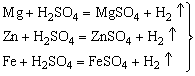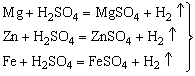| 金属的化学性质(1) |
主讲: 化学高级教师 舒宝生
创设情景:黄铜(铜锌合金)与黄金的外观相似,可以用什么方法鉴别它们?
(1)黄铜与黄金的密度不同,测密度可区别它们;
(2)黄铜与黄金的硬度不同,把它们相互刻画,硬度大的为黄铜。
(3)“真金不怕火炼”,用火烧一下,变黑的为黄铜,不变色的为黄金。
……
(1)(2)利用的是金属的物理性质,(3)利用的是金属的化学性质。
过渡引入:前面学习了物理性质,这节课学习化学性质,然后思考还有什么方法可以区分?
展示:被空气中氧气氧化的镁条和铝片,再用砂纸打磨,比较。
问:黄铜灼烧为什么变黑,镁条、铝片在空气中会变暗?
讲解:镁、铝在常温下就能与氧气反应。同时,前面还学习了铁丝能在氧气中燃烧,下面继续学习金属与氧气的反应。
一、金属与氧气的反应
演示:镁条、铝片、铜片在空气中加热。
现象:燃烧、失去光泽、变黑
大多数金属都能与氧气发生反应,但反应的难易和剧烈程度不同。
讲解:镁、铝等在常温下就能与氧气反应,铁、铜等在常温下几乎不与氧气反应,但在高温时能与氧气反应,“真金不怕火炼”说明金即使在高温时也不与氧气反应。
板书:
2Mg+O2=2MgO
4Al+3O2=2Al2O3
3Fe+2O2
Fe3O4
2Cu+O2
2CuO
由此,可以判断这些金属的活动性顺序为:
Mg,Al>Fe,Cu>Au
注意:铝具有很好的抗腐蚀性能,其原因是铝表面能生成一层致密的氧化物薄膜。
应用:
(1)比较金属的活动性;
(2)鉴别物质,如:黄铜和金
过渡:金属还可与盐酸或稀硫反应,通过金属与酸能否反应或反应的剧烈程度,也可比较金属的活动性顺序。
二、金属与酸反应
演示:Mg+稀HCl(√) Mg+稀H2SO4(√)
Zn+稀HCl(√) Zn+稀H2SO4(√)
Fe+稀HCl(√) Fe+稀H2SO4(√)
Cu+稀HCl(×) Cu+稀H2SO4(×)
分析:
现象:
1、Mg、Zn、Fe都可与稀HCl(或稀H2SO4)反应,铜与稀HCl(或稀H2SO4)不反应。
2、Mg、Zn、Fe与稀盐酸反应的剧烈程度不同(即产生气泡的快慢程度不同),镁最快,其次是锌,然后是铁。
结论:活动性顺序:Mg>Zn>Fe>Cu
过渡:还有没有其它方法证明金属的活动性强弱顺序呢?
三、金属与盐溶液反应
盐:由金属阳离子和酸根离子所形成的化合物。
如:NaCl、CuSO4、FeSO4、KMnO4、CaCO3等。
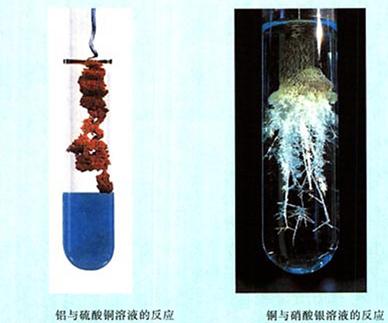
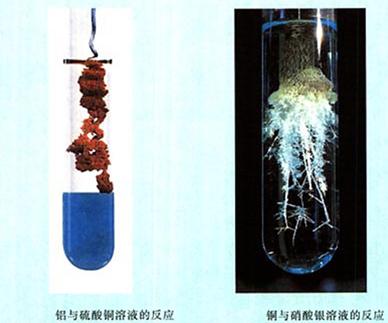
演示:Al+CuSO4溶液
Cu+AgNO3溶液
Cu+Al2(SO4)3溶液
分析:
现象:Al和CuSO4溶液反应,铝丝表面有红色物质附着,溶液逐渐变为无色;
Cu和AgNO3溶液反应,铜丝表面有银白色物质生成,溶液逐渐变为蓝色;Cu和Al2(SO4)3溶液不反应。
结论:活动性顺序:Al>Cu>Ag
四、金属活动性顺序
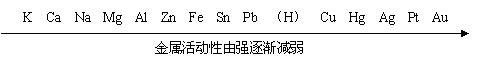
回顾:
五、置换反应
由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应。
如:
练习:
总结:
一、金属的化学性质
1、金属与氧气反应
如:4Al+3O2=2Al2O3; 3Fe+2O2
Fe3O4;2Cu+O2
2CuO
2、金属与酸反应
Mg+2HCl=MgCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
3、金属与盐溶液反应
Cu+2AgNO3=Cu(NO3)2+2Ag
二、金属的活动性顺序
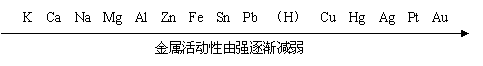
思考:如何区分黄铜和黄金?
例题:铁、镁、铝等金属在日常生活中都有较广泛的用途。请写出下列反应的化学方程式,并在后面的括号内注明反应类型。
(1)镁在空气中燃烧能发出耀眼的白光,可用来制造镁闪光灯。
____________________________________________________________( )
(2)市售的补血麦片中常含有微量颗粒极细的铁粉,它与胃液中的盐酸作用转化为亚铁盐,从而起到补铁作用。
____________________________________________________________( )
(3)铝制器皿在空气中表面易形成一层白色保护膜。
____________________________________________________________( )
(4)曾青得铁则化为铜,这是湿法炼铜的原理。
____________________________________________________________( )
答案:
(1)2Mg+O2
2MgO(化合反应)
(2)Fe+2HCl=FeCl2+H2↑(置换反应)
(3)4Al+3O2=2Al2O3(化合反应)
(4)Fe+CuSO4=FeSO4+Cu(置换反应)
- 返回 -