| 金属的化学性质(3) |
主讲: 化学高级教师 舒宝生
复习:金属活动性顺序的应用:
1、在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。
2、在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
3、在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液里置换出来。
一、金属和盐溶液的反应
注意问题:
(1)在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液里置换出来。
(2)K、Ca、Na除外。
(3)盐必须是可溶性盐。
1、一种金属和一种盐溶液反应
如:将一定量的铁放入一定量的CuSO4溶液中。
分析:Fe+CuSO4=FeSO4+Cu
可能情况
反应后的金属
反应后的溶液
铁剩余
恰好完全反应
CuSO4剩余
2、一种金属和两种盐溶液反应
如:将一定量的铁放入Cu(NO3)2和AgNO3的混合溶液中。
分析:Fe+Cu(NO3)2=Fe(NO3)2+Cu
Fe+2AgNO3=Fe(NO3)2+2Ag
[板书有误:此处视频中误将Cu(NO3)2写成了Cu(NO3)。]
可能情况
反应后的金属
反应后的溶液
铁未将AgNO3反应完
铁恰好将AgNO3反应完
铁将Cu(NO3)2反应一部分
铁将Cu(NO3)2反应完
铁剩余
思考:
1、将一定量的铁放入MgSO4和CuSO4的混合溶液中,怎样考虑?
2、将一定量铁放入Cu(NO3)2、AgNO3和Mg(NO3)2的混合溶液中,该怎样考虑?
例1、在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,没有气泡产生。下列判断正确的是( )
A.滤出的固体中一定含有铜,可能含有铁和镁
B.滤出的固体一定含有铜,一定不含铁和镁
C.滤液中一定含有氯化镁和氯化亚铁,不含有氯化铜
D.滤液中一定含有氯化镁、氯化亚铁、氯化铜
答案:B
解析:
“向滤出的固体中滴加稀盐酸,没有气泡产生说明一定不含铁和镁。
例2、印刷铜制电路板的“腐蚀液”为FeCl3溶液。已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2。现将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是( )
A.溶液中一定含FeCl3,固体一定是铁和铜
B.溶液中一定含FeCl2,固体一定含铜
C.溶液中一定含FeCl2、CuCl2,固体一定含铜
D.溶液中一定含FeCl2,固体一定是铁和铜
答案:B
解析:
充分反应后烧杯中仍有少量固体,说明FeCl3已反应完,而且一定生成FeCl2,同时由于铁可与CuCl2反应,可认为FeCl3溶液与铜、铁反应时应先与铁反应,所以此题中有铜剩余。
二、金属化学性质的综合运用
1、比较金属活动性顺序方法:
(1)金属与氧气反应
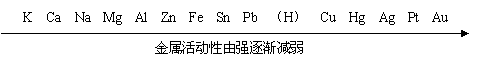
(2)金属与酸反应
在金属活动性顺序里,位于氢前面的金属能置换出酸中的氢;金属越活泼,与酸反应生成氢气的速率越快。
(3)金属与盐溶液反应
在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。
例3、A、B、C、D是四种金属单质,A能从B的硝酸盐溶液中置换出B,但A不能与稀盐酸反应。相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是( )
A.A、B、C、D B.B、A、C、D
C.D、C、A、B D.D、C、B、A
答案:C
解析:
“A能从B的硝酸盐溶液中置换出B,但A不能与稀盐酸反应。”说明活泼性A>B,且都排在氢之后。“相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。”说明活泼性D>C,且都排在氢之前。
2、设计(或判断)金属活动性顺序的方案
原理:利用金属与酸或盐溶液反应
例4、利用组内物质反应可比较金属活动性顺序的是
(1)Cu、Ag、FeSO4溶液(×)
(2)Fe、Ag、CuSO4溶液(√)
(3)Fe、Cu、AgNO3溶液(√)
(4)Cu、FeSO4溶液、AgNO3溶液(√)
(5)Fe、Cu、AgCl(×)
(6)Fe、Cu、Ag、HCl(×)
(7)Mg、Fe、Cu、HCl(√)
思考:选择适当的物质,如何设计方案比较Zn、Fe、Cu的活动性顺序?
3、溶液质量变化分析
例5、将铁片放入下列溶液中,溶液的质量会减轻的是( )
A.HCl B.H2SO4
C.ZnSO4 D.CuSO4
答案:D
解析:
铁与HCl或H2SO4反应时,溶液增加铁而减少的是氢气,增加的比减少的多,最终溶液的质量增加;铁与ZnSO4不反应,ZnSO4溶液的质量应不变;铁与CuSO4溶液反应时,溶液增加铁而减少的是铜,增加的比减少的少,最终溶液的质量减少。
4、实验现象的描述
从金属和溶液两个不同的角度分别描述。
(1)Fe+2HCl=FeCl2+H2↑
现象为:有气泡产生;溶液由无色逐渐变为浅绿色。
(2)Fe+CuSO4=FeSO4+Cu
现象为:铁表面有红色固体生成,溶液由蓝色逐渐变为浅绿色。
(3)Cu+2AgNO3=Cu(NO3)2+2Ag
现象为:铜表面有银白色固体(或黑色固体)生成,溶液由无色逐渐变为蓝色。
三、置换反应的种类
置换反应:一种单质跟一种化合物反应,生成另一种单质和另一种化合物的反应。
(1)金属置换出非金属
(2)金属置换出金属
(3)非金属置换出金属
(4)非金属置换出非金属
总结:
一、金属和盐溶液的反应
二、金属化学性质的综合运用
三、置换反应的种类
- 返回 -