| 溶液的形成(1) |
主讲: 化学高级教师 舒宝生
展示:CuSO4溶液(蓝色)、品红溶液(红色)、FeCl3溶液(黄色)、NaCl溶液(无色)
讲解:这些液体都是溶液,属于混合物。
过渡:现在我们就一起开始学习溶液,那么溶液是怎样形成的呢?
课题1 溶液的形成
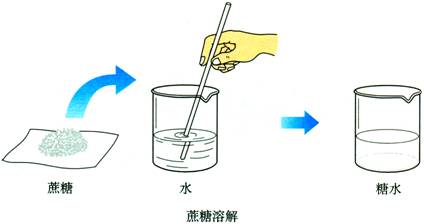
活动:蔗糖溶于水、食盐溶于水
展示:
讲解:从微观角度解释蔗糖、食盐溶于水(分解或扩散)
说明:前面展示的溶液和现在的蔗糖溶于水、食盐溶于水一样,各部分均匀,没有沉淀析出,是一种稳定的混合物。
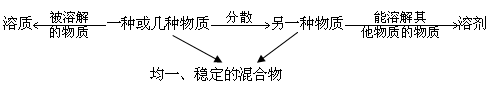
一、溶液
一种或几种物质分散到另一种物质里,形成均一的稳定的混合物。
说明:按书写顺序显示
1、溶液的基本特征:均一、稳定
(1)溶液不一定无色,如:CuSO4溶液(蓝色)、FeCl3溶液(黄色)、FeSO4溶液(浅绿色)、KMnO4溶液(紫色)、NaCl溶液(无色)。
(2)无色液体不一定是溶液,如:水、乙醇等
2、溶液质量=溶质的质量+溶剂的质量
溶液的体积≠溶质的体积+溶剂的体积
3、某溶液中溶质可以只有一种,也可以是两种或两种以上。
4、溶质可以是固体、液体或气体;水是最常用的溶剂。
5、溶液的用途
展示:
二、溶质和溶剂的判断
固体、气体溶于液体时,液体为溶剂。
两种液体互溶时
注意:
(1)SO3、Na2O等易与水反应的物质溶于水,溶质不是SO3、Na2O,而是H2SO4、NaOH。
(2)当两种物质完全反应后,新生成的物质是溶质,而析出的沉淀或气体不是溶质,溶剂仍是水。如:Zn放入稀H2SO4后,若恰好完全反应,所得到的溶液中溶质是ZnSO4。
三、溶液的读法
一般读作“溶质的溶剂”溶液;有水时,直接读作“溶质”溶液。
如:
NaOH溶于水:NaOH溶液;
I2溶于酒精:碘的酒精溶液;
I2溶于汽油:碘的汽油溶液;
CuSO4溶于水;CuSO4溶液。
活动:①碘加入水中 ②碘加入汽油中 ③KMnO4加入水中 ④KMnO4加入汽油中
展示:
结论:
(1)同种溶质在不同溶剂中溶解能力不同。
(2)不同溶质在同种溶剂中溶解能力不同。
四、影响溶解能力的因素
主要是:溶质的种类、溶剂的种类。
总结:
一、溶液
一种或几种物质分散到另一种物质里,形成均一的稳定的混合物。
二、溶质、溶剂的判断
三、溶液的读法
四、影响溶解能力的因素
主要是:溶质的种类、溶剂的种类。
例1、通过学习化学,我们澄清了许多有关溶液的错误认识,逐步了解了溶液的本质。请参照示例,否定下列错误的认识。
有关认识
否定例证
只有固体物质才能做溶质
医用酒精中的溶质乙醇是液体
只有水才能做溶剂
溶液都是无色的液体
溶液中的溶质只有一种
无色透明的液体是溶液
答案:
有关认识
否定例证
只有固体物质才能做溶质
医用酒精中的溶质乙醇是液体
只有水才能做溶剂
碘酒中的溶剂为酒精
溶液都是无色的液体
硫酸铜溶液是蓝色的
溶液中的溶质只有一种
盐水和糖水的混合溶液中溶质有两种
无色透明的液体是溶液
水是无色透明的液体,但不是溶液
例2、写出下列溶液中溶质的化学式:
(1)石灰水__________;
(2)锌与稀硫酸恰好完全反应的溶液__________;
(3)医用碘酒__________;
(4)80mL酒精与20mL水组成的溶液__________;
(5)浓盐酸__________;
(6)0.9%的生理盐水__________;
(7)2g的甲醇与8g乙醇混合形成的溶液__________;
(8)白磷的二硫化碳溶液__________;
(9)将胆矾溶于水后形成的溶液__________;
(10)CaO完全溶于水后形成的溶液__________。
答案:
(1)Ca(OH)2 (2)ZnSO4 (3)I2 (4)C2H5OH (5)HCl (6)NaCl
(7)CH3OH (8)P (9)CuSO4 (10)Ca(OH)2
- 返回 -