| 溶解度(1) |
主讲: 化学高级教师 舒宝生
引入:在一定量的水中,能否无限制地溶解某种物质呢?
活动与探究1:
记录:
现象
NaCl没有剩余,完全溶解
NaCl有剩余,未溶解完
NaCl没有剩余,又溶解完
结论
20mL水中能将5g NaCl溶解完
20mL水中不能将5g NaCl溶解完
加水时,又能使NaCl继续溶解
(1)向一定量溶剂里加入某种溶质,溶质可能出现不能完全溶解,而且再不能继续溶解该种溶质。
(2)若增加溶剂,未溶解完的溶质又能继续溶解。
活动与探究2:向一定量水中加入KNO3至KNO3不能溶解完,加热观察现象。
现象:未溶解完的KNO3又继续溶解完。
一、饱和溶液
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做饱和溶液。还能继续溶解的溶液,叫做不饱和溶液。
注意:
(1)要注意指明“一定温度”、“一定量溶剂”。因为改变溶剂的量或温度,饱和溶液与不饱和溶液可以相互转化。
(2)要注意指有“某一溶质”的饱和溶液或不饱和溶液,因为对一种物质饱和可能对其它物质不一定饱和。
演示:向饱和的NaCl溶液中加入KNO3观察能否溶解。
二、溶液是否饱和的判断方法
看能否继续溶解该种溶质,若能继续溶解,说明不饱和;若不能继续溶解,说明饱和。
注意:有晶体析出的溶液一定是饱和溶液;没有晶体析出的溶液不一定是不饱和溶液。
展示:热的KNO3溶液冷却后的现象
三、结晶
1、概念:已溶解在溶液中的溶质以晶体的形式析出的过程叫做结晶。
2、结晶的方法
(1)蒸发结晶
(2)冷却结晶(或降温结晶)
过渡:结晶先必须使溶液变为饱和溶液,再使晶体析出。
四、饱和溶液和不饱和溶液的转化
注意:溶质为Ca(OH)2或气体等物质除外。
练习:请判断在下列情况下,溶质、溶剂、溶液的变化情况(填“增大”、“不变”、“变小”)。
溶液
溶质
溶剂
剩余溶液是否饱和
改变温度无晶体析出
不变
不变
不变
不一定
改变温度析出晶体
变小
变小
不变
饱和
加溶剂
变大
不变
变大
不饱和
蒸发溶剂(无晶体析出)
变小
不变
变小
不一定
蒸发溶剂(有晶体析出)
变小
变小
变小
饱和
向不饱和溶液中加溶质
变大
变大
不变
不一定
向饱和溶液中加溶质
不变
不变
不变
饱和
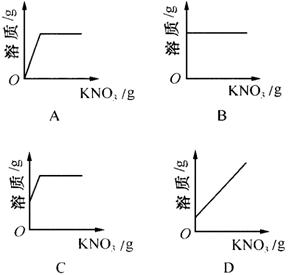
例1、向一瓶接近饱和的KNO3溶液中,逐渐加入KNO3晶体,下图中符合溶液中溶质的质量变化规律的是( )
答案:C
解析:
接近饱和的KNO3溶液可以溶解少量的溶质就变成饱和溶液,变成饱和溶液后就不能再溶解溶质。
例2、在一定温度下,某固态溶质(不含结晶水)的水溶液甲,经历如下变化:
下列结论正确的是(多选)( )
A.溶液甲可能是饱和溶液
B.溶液乙一定是不饱和溶液
C.溶液乙和溶液丙中的溶质质量分数可能相等
D.溶液丙若再蒸发5g水,析出的晶体可能大于2g
答案:CD
例3、常温下,在两只各盛有100mL水的烧杯中,分别加入相同质量的甲、乙两种物质,使其充分溶解,结果如下图所示。下列说法正确的是( )
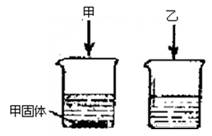
A.甲溶液是不饱和溶液
B.常温下,甲、乙两种物质的溶解度相同
C.升高温度,剩余的甲固体一定能继续溶解
D.乙溶液可能是饱和溶液,也可能是不饱和溶液
答案:D
解析:
甲未溶解完,甲溶液是饱和溶液;常温下,在两只各盛有100mL水的烧杯中,分别加入相同质量的甲、乙两种物质,甲未溶解完而乙溶解完,说明甲的溶解度在常温下小于乙的溶解度。
总结:
一、饱和溶液和不饱和溶液
二、饱和溶液与不饱和溶液的判断方法
看能否继续溶解该种溶质,若能继续溶解,说明不饱和;若不能继续溶解,说明饱和。
三、结晶
1、定义
2、方法:(1)蒸发结晶 (2)降温结晶
- 返回 -