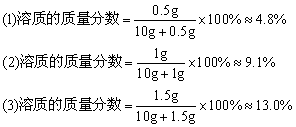| 溶质的质量分数(1) |
主讲: 化学高级教师 舒宝生
展示:三种颜色深浅不同的CuSO4溶液。
讲解:三种溶液颜色不同实际上是因为浓度不同。那么溶液的颜色深浅与溶液的浓或稀有什么关系呢?
活动与探究:
在三支试管中各加入10mL水,然后分别加入约0.5g、1g、1.5g固体硫酸铜。比较三种CuSO4溶液的颜色。在这三支试管中溶液的组成是否相同?判断溶液浓稀的根据是什么?
结论:(1)三种溶液含溶剂质量相同,溶质质量不同,所以溶液组成不同。
(2)三种溶液颜色越深,溶液浓度越大。
一、对于有色溶液,根据颜色深浅可以区分溶液的浓或稀。
说明:颜色深浅只能粗略的区分浓或稀,不能准确的表示溶液的组成;无色溶液不能用这种方法区分浓或稀。
引入:如何表示溶液的组成呢?
二、溶质的质量分数
1、概念:溶质的质量与溶液的质量之比。
2、表达式
活动:上述探究中,三种溶液中溶质的质量分数是多少?
3、溶质的质量分数越大,溶液越浓。
4、0<溶质的质量分数<1
活动与探究:
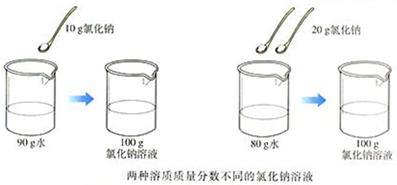
按下表所定的量配制氯化钠溶液(水的密度可看做是1g/cm3)。
溶质质量/g |
溶剂(水)质量/g |
溶液中溶质的质量分数 |
10 |
90 |
|
20 |
80 |
|
问题:对于NaCl溶液,能否通过颜色比较溶液的浓或稀?通过溶质的质量分数能否比较溶液的浓或稀?
NaCl溶液是无色溶液,不能通过颜色比较溶液的浓或稀;溶质的质量分数可以比较溶液浓或稀(即浓度的大小),还能表示溶液的组成。
5、注意:
(1)溶质的质量分数是溶液组成的一种表示方法。所指溶液可以是饱和溶液,也可以是不饱和溶液;可以是浓溶液,也可以是稀溶液。
(2)溶质的质量分数只有在一定温度下的溶解度范围内才有意义。
如:20℃时,NaCl的溶解度为36g,那么20℃时,NaCl溶液的溶质的质量分数应不能超过
。
(3)注意找准溶质、溶剂、溶液的质量。
①结晶水合物溶于水,其溶质指不含结晶水的化合物。
②某些化合物溶于水时能与水反应,如:CaO、SO3等,其溶质分别为Ca(OH)2、H2SO4,而不是CaO、SO3。
③注意化学反应后剩余溶液的溶质。
三、如何用溶质的质量分数解决实际问题
例1、在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解:
溶质质量=溶液质量×溶质的质量分数
=150kg×16%=24kg
溶剂质量=溶液质量-溶质质量
=150kg-24kg
=126kg
答:配150kg质量分数为16%的氯化钠溶液需24kg氯化钠和126kg水。
例2、现有40g溶质的质量分数为15%的KNO3溶液,若向其中加入10g KNO3或10g水(假设能全部溶解),计算所得溶液中溶质的质量分数各为多少?
答案:32%、12% 。
小结:一般增加溶质质量,溶质和溶液质量同时增加,溶质的质量分数变大(溶质要溶解);增加溶剂质量,溶剂和溶液的质量同时增加,溶质的质量分数变小。
总结:溶质的质量分数
1、概念
2、表达式
3、溶质的质量分数越大,溶液越浓,可用溶质的质量分数表示溶液的浓或稀。
- 返回 -