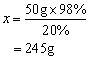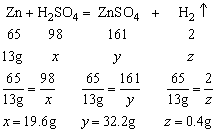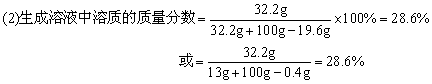| 溶质的质量分数(2) |
主讲: 化学高级教师 舒宝生
复习:
溶质的质量分数的计算
(1)
(2)溶质质量=溶液质量×溶质的质量分数
(3)溶液质量=溶质质量÷溶质的质量分数
一、溶质、溶剂、溶液的质量与溶质的质量分数的换算
例1、在80g溶质的质量分数为15%的NaNO3溶液里含NaNO3多少克?若向其中加入20g水后,所得溶液中溶质的质量分数变为多少?
答案:12g;12%
二、溶液的稀释与浓缩
例2、将1g食盐加入9g水中至完全溶解,再向其中加入10g水稀释,分析:
稀释前:溶质为__________g,溶液为__________g,溶质的质量分数为__________。
稀释后:溶质为__________g,溶液为__________g,溶质的质量分数为__________。
结论:溶液稀释前后,溶质的质量不变。
(溶液稀释过程中溶液的质量增加,溶质的质量分数变小)。
例3、化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
分析:
溶液稀释前后,溶质的质量不变。
解:
设:稀释后溶液的质量为x。
50g×98%=x×20%
需要水的质量=245g-50g=195g
答:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要195g水。
三、溶质的质量分数与溶液体积、溶液密度有关的换算
例4、配制500mL 20%(密度为1.14g/cm3)的硫酸需要98%(密度为1.84g/cm3)的浓硫酸多少mL?需水多少mL?
解:
设需98%的硫酸的体积为x,根据稀释前后溶质的质量不变。
x×1.84g/cm3×98%=500cm3×1.14g/cm3×20%
x=63.2cm3
需水的质量=稀溶液的质量-浓溶液的质量
=500cm3×1.14g/cm3-62.3cm3×1.84g/cm3
=453.7g
过渡:还会有溶液间化学反应的问题
四、根据化学方程式的溶质的质量分数的计算
例5、100g某硫酸恰好与13g锌完全反应。试计算:
(1)这种硫酸中溶质的质量分数;
(2)反应后生成溶液的溶质的质量分数。
解:
设硫酸中溶质的质量为x,生成ZnSO4的质量为y,生成H2的质量为z
答:(1)硫酸溶质的质量分数为19.6%;
(2)生成溶液中溶质的质量分数为28.6%。
总结:
1、参加化学反应的是溶液中的溶质,计算时用纯净物计算。
2、求反应后所得溶液的质量的两种方法
(1)溶液组成法
溶液质量=溶质质量+溶剂质量,其中溶质一定是溶解的那部分,水通常有两种情况:
原溶液中的水和化学反应新生成的水。
(2)质量守恒法
m(溶液)=m(反应物)-m(不溶性杂质)-m(沉淀)-m(气体)
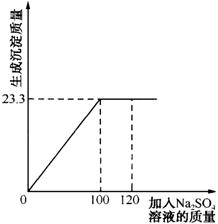
例6、将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2mL水中(ρ水=1g/cm3),向所得溶液中滴加质量分数为14.2%的Na2SO4溶液,至恰好完全反应。下图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算:
(1)生成沉淀的质量是多少?
(2)所得溶液中溶质的质量分数为多少?
解析:
(1)由图可知,生成BaSO4沉淀的质量为23.3g
(2)设BaCl2的质量为x,生成NaCl的质量为y
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
208 233 117
x 23.3g y
x=20.8g
y=11.7g
溶液的总质量=29.1g+94.2g+100g-23.3g=200g
溶质的总质量=11.7g+(29.1g-20.8g)=20g
NaCl%=20/200×100%=10%
答:生成沉淀23.3g,所得NaCl溶液的质量分数为10%。
总结:
一、溶质、溶剂、溶液的质量与溶质的质量分数的换算
二、溶液的稀释与浓缩:
溶液稀释前后,溶质的质量不变。
三、溶质的质量分数与溶液体积、溶液密度有关的换算
四、根据化学方程式的溶质的质量分数的计算
反应后所得溶液的质量的两种方法
(1)溶液组成法
溶液质量=溶质质量+溶剂质量,其中溶质一定是溶解的那部分,水通常有两种情况:
原溶液中的水和化学反应新生成的水。
(2)质量守恒法
m(溶液)=m(反应物)-m(不溶性杂质)-m(沉淀)-m(气体)
- 返回 -