| 常见的酸和碱(2) |
主讲: 化学高级教师 舒宝生
复习:1、酸:仅能电离出H+和酸根离子的化合物。
如:HCl、H2SO4、HNO3、CH3COOH
2、常见的酸——盐酸
(1)物理性质
(2)化学性质
(3)用途
一、常见的酸——硫酸(H2SO4)
1、物理性质
无色液体,不挥发。浓硫酸是粘稠、油状液体,有吸水性。
2、化学性质(稀硫酸)
(1)可使指示剂显色
(2)可与活泼金属反应产生氢气
Mg+H2SO4;Fe+H2SO4;Al+H2SO4;Zn+H2SO4
(3)可与部分金属氧化物反应
演示:将生锈的铁钉放入盛有稀硫酸的试管里,过一会儿取出,用水洗净,观察铁钉和溶液颜色有什么变化?
现象:铁钉上的铁锈被除掉,溶液由无色变为黄色。
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
3、用途
重要化工原料,用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
浓硫酸有吸水性,在实验室中常用它做干燥剂。
过渡:常见的酸还有硝酸(HNO3)、醋酸(CH3COOH)等。
二、酸的通性
酸具有相似的化学性质的原因,酸都能解离出相同的离子——H+。
1、都能使指示剂显色。
2、都能与活泼金属反应生成氢气(浓H2SO4、HNO3除外)(置换反应)。
3、能与某些金属氧化物反应(复分解反应)。
4、能与某些盐反应(复分解反应)。
CaCO3+2HCl=CaCl2+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
AgNO3+HCl=AgCl↓+HNO3
BaCl2+H2SO4=BaSO4↓+2HCl
复分解反应:两种化合物互相交换成分生成另外两种化合物的反应。
三、浓硫酸的特性
1、吸水性:可用作干燥剂。
思考:浓硫酸与浓盐酸放在空气中变稀的原因。
2、脱水性
3、强氧化性
浓硫酸与金属反应不生成氢气。
4、浓硫酸溶于水放出大量的热。
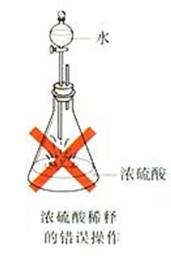
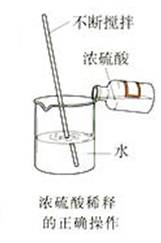
(1)浓硫酸的稀释方法
在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。不可将水倒进浓硫酸里。
(2)如果不慎将浓硫酸沾到皮肤上,应立即用干布拭去,然后立即用大量的水冲洗,然后涂上3%~5%的碳酸氢钠溶液。
思考:如果将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理?
四、酸的分类和命名
1、根据酸分子解离时生成的H+个数
一元酸:如:HCl、HNO3、CH3COOH
二元酸:如:H2SO4、H2CO3、H2SO3
三元酸:如:H3PO4
2、根据酸分子中是否含有氧原子
注意:含氧酸命名时一般称为“某酸”;
无氧酸命名时,一般称为“氢某酸”。
3、根据酸性的强弱
总结:
一、常见的酸——硫酸(H2SO4)
二、酸的通性
三、浓硫酸的特性
四、酸的分类
- 返回 -