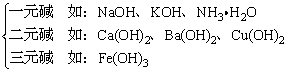| 常见的酸和碱(3) |
主讲: 化学高级教师 舒宝生
复习:碱:仅能电离出金属阳离子(或NH4+)和OH-的化合物。
如:NaOH、Ca(OH)2、KOH、Ba(OH)2、Cu(OH)2、NH3·H2O等。
一、常见的碱
Ⅰ.氢氧化钠(NaOH)
1、俗名:苛性钠、火碱、烧碱
2、物理性质:白色固体,易溶于水,且溶解时放出大量的热。
易潮解(①NaOH固体应密封保存;②NaOH固体可做某些气体的干燥剂。)
3、化学性质
(1)可使指示剂变色
(2)可与某些非金属氧化物反应
2NaOH+CO2=Na2CO3+H2O(应用于吸收CO2)
2NaOH+SO2=Na2SO3+H2O
思考:①NaOH固体或溶液放置在空气中易变质,根据其变质的程度分析可能存在哪几种情况?
②NaOH的变质和NaOH的潮解有何不同?
回顾:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
(3)可与某些盐反应
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
(红褐色沉淀)
FeCl2+2NaOH=Fe(OH)2↓+2NaCl
(白色沉淀)
4、用途
(1)氢氧化钠是一种重要的化工原料,广泛应用于肥皂、石油、造纸、纺织和印染等工业。
(2)某些气体的干燥剂。
(3)在生活中可用来去除油污,如炉具清洁剂中就含有氢氧化钠。
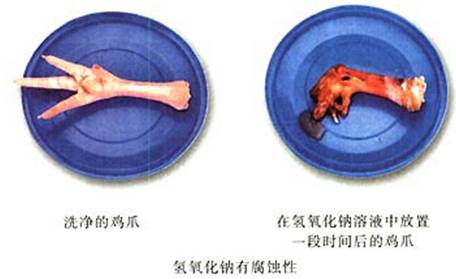
使用NaOH的注意事项:NaOH有强烈的腐蚀性,如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
5、NaOH的制法
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ⅱ.氢氧化钙[Ca(OH)2]
1、俗名:熟石灰、消石灰
2、物理性质
白色粉末状固体,微溶于水。
3、化学性质
(1)可使指示剂变色。
(2)可与某些非金属氧化物反应。
Ca(OH)2+CO2=CaCO3↓+H2O (用于检验CO2)
Ca(OH)2+SO2=CaSO3+H2O
Ca(OH)2+SO3=CaSO4+H2O
思考:Ca(OH)2在空气中变质与NaOH在空气中变质的相似点。
(3)可与某些盐反应。
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
4、用途
Ca(OH)2可用于建筑材料,农业上中和酸性土壤,工业上中和工厂废水等。
5、Ca(OH)2的制法
CaO+H2O=Ca(OH)2
注意:①该反应放热;②CaO可用作干燥剂。
二、碱的通性
碱具有相似的化学性质的原因:碱都能解离出相同的离子——OH-。
1、可溶性碱能使指示剂变色;
2、可溶性碱能与某些非金属氧化物反应;
3、可溶性碱能与某些可溶性盐反应。
三、碱的分类和命名
1、电离出OH-个数
2、根据溶解性
3、根据强弱
注意:碱命名为“氢氧化某”,若所含金属元素有可变价态,低价金属的碱命名为“氢氧化亚某”,如:Fe(OH)2:氢氧化亚铁。
总结:
一、常见的碱
二、碱的通性
三、碱的分类和命名
- 返回 -