| 酸和碱之间会发生什么反应(1) |
主讲: 化学高级教师 舒宝生
复习:1、酸:仅能电离出H+和酸根离子的化合物。
如:HCl、H2SO4、HNO3、CH3COOH等。
H2O、C2H5OH、CH4含有氢元素,但不是酸。
2、碱:仅能电离出金属阳离子(或NH4+)和OH-的化合物。
如:NaOH、Ca(OH)2、KOH、Ba(OH)2、NH3·H2O等。
引入:
为什么酸具有酸的通性,碱具有碱的通性?
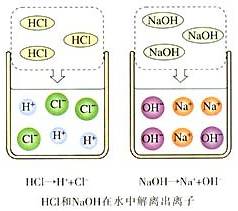
探究:如图所示,分别试验盐酸、硫酸、氢氧化钠溶液、氢氧化钙溶液、蒸馏水和乙醇的导电性。
现象:蒸馏水和乙醇不导电,而盐酸、硫酸、氢氧化钠溶液和氢氧化钙溶液却能导电。
HCl在水中会解离出H+和Cl-,H2SO4在水中会解离出H+和SO42-;NaOH在水中会解离出Na+和OH-,Ca(OH)2在水中会解离出Ca2+和OH-;水和乙醇很难电离出带电的粒子。
复习:酸的通性
碱的通性
问:酸与碱之间能发生化学反应吗?
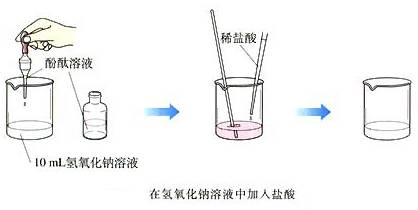
活动探究:如图所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞溶液。再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成无色为止。
现象:溶液中红色褪去。
结论:NaOH与HCl发生了化学反应。
分析:
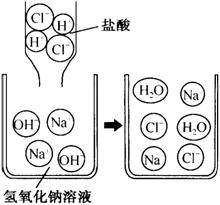
NaOH+HCl=NaCl+H2O
其它的酸和碱也能发生类似的化学反应。
一、盐
能电离出金属离子(或NH4+)和酸根离子的化合物叫做盐。
如:NaCl、Na2SO4、CaCl2、BaSO4、CaCO3、KMnO4、KClO3、KCl等。
二、中和反应
酸与碱作用生成盐和水的反应,叫做中和反应。
如:NaOH+HCl=NaCl+H2O
Ca(OH)2+2HCl=Ca Cl2+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
Ba(OH)2+H2SO4= BaSO4↓+2H2O
Mg(OH)2+2HCl=MgCl2+2H2O
注意:
1、中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。
如:(1)酸和某些金属氧化物反应生成盐和水。
2HCl+CuO=CuCl2+H2O
(2)碱和某些非金属氧化物反应生成盐和水。
Ca(OH)2+CO2=CaCO3↓+H2O
2、中和反应的实质是酸中的H+与碱中的OH-结合成水:H++OH-=H2O。
3、中和反应一般现象不明显(无沉淀、气体产生,无颜色改变),所以反应中借助酚酞试液的颜色变化判断反应是否恰好完成。
4、中和反应属于复分解反应。
思考:向一定量NaOH溶液中滴加酚酞试液,再加入一定量HCl,溶液为无色。问是否恰好反应?可用什么实验进行判断?
小结:
酸的通性
1、都能使指示剂显色;
2、都能与活泼金属反应生成氢气;
3、能与某些金属氧化物反应;
4、能与某些盐反应;
5、酸能与碱作用生成盐和水的反应。
碱的通性
1、可溶性碱能使指示剂变色;
2、可溶性碱能与某些非金属氧化物反应;
3、可溶性碱能与某些可溶性盐反应;
4、碱能与酸作用生成盐和水的反应。
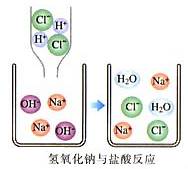
例1、下图是盐酸滴入氢氧化钠溶液中,有关粒子之间反应的示意图。下列说法错误的是( )
A.盐酸溶液中含有氢离子和氯离子
B.氢氧化钠溶液中含有钠离子和氢氧根离子
C.两种溶液混合时,氢离子与氢氧根离子结合生成了水分子
D.两种溶液混合时,钠离子与氯离子结合生成了氯化钠分子
解析:
此题属于化学建模题。我们要学会从模型中看出其中的内容。
从图中可知,盐酸和氢氧化钠都是离子化合物,盐酸溶液中含有氢离子和氯离子,氢氧化钠溶液中含有钠离子和氢氧根离子,即A、B均正确,而从题中可知生成物水中的氢离子与氢氧根离子结合在一起是水分子,而钠离子与氯离子是在溶液中移动,是离子化合物,不是氯化钠分子。所以D错误。
答案:D
例2、实验室用盐酸与氢氧化钠溶液作用探究中和反应时,看不到明显的实验现象。此时,采用下列一些做法,其中正确的是( )
A.用稀硫酸代替稀盐酸
B.放弃对中和反应的实验探究
C.用氢氧化钾代替氢氧化钠
D.实验前向氢氧化钠溶液中滴加2滴酚酞试液
答案:D
总结:
一、盐
二、中和反应
三、酸的通性、碱的通性
- 返回 -