| 生活中常见的盐(1) |
主讲: 化学高级教师 舒宝生
复习:酸、碱、盐的定义
酸:仅能电离出H+和酸根离子的化合物。
碱:仅能电离出金属阳离子(或NH4+)和OH-的化合物。
盐:能电离出金属阳离子(或NH4+)和酸根离子的化合物。
生活中常见的盐:
氯化钠NaCl(食盐的主要成分)
碳酸钠Na2CO3(俗称:纯碱、苏打)
碳酸氢钠NaHCO3(俗称:小苏打)
高锰酸钾KMnO4
碳酸钙CaCO3(大理石的主要成分)
讲解:日常生活中所说的盐,通常指食盐,而化学中的盐有CuSO4、NaCl、Na2CO3、NaHCO3等,我国曾多次发生将工业用盐(如NaNO2)误作食盐用烹调而引起的中毒事件。
一、氯化钠(NaCl)
食盐的主要成分
1、氯化钠的用途
(1)食盐是一种重要的调味品;
(2)医疗上用氯化钠配制生理盐水;
(3)农业上可用NaCl溶液来选种;
(4)工业上可以用NaCl为原料来制取Na2CO3、NaOH、Cl2和盐酸等;
(5)可用食盐腌渍蔬菜、鱼、肉、蛋等;
(6)公路上的积雪也可用NaCl来消除,等等。
资料:
(1)清晨起来喝一杯淡盐水,可治大便不通;
(2)用盐水洗头可减少头发脱落;
(3)茄子根加点盐水洗脚,可治脚气病;
(4)皮肤被热水烫了,用盐水洗一下可减轻疼痛;
(5)演讲、作报告、唱歌前喝点淡盐水,可避免喉干嗓哑;
(6)洗衣服时加点盐,能有效防止褪色;
(7)把胡萝卜咂成糊状,拌上盐可以擦衣服上的血迹;
(8)炸东西时,在油里放点盐,油不外溅。
讲解:氯化钠在自然界的分布
氯化钠在自然界分布很广,海水、盐湖、盐井、盐矿中都蕴藏着大量的氯化钠。人们通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去其水分,得到含有较多杂质的氯化钠晶体——粗盐。将粗盐再次经过加工提纯可以得到精盐。
2、粗盐提纯
(1)粗盐中的杂质:可溶性杂质(MgCl2、CaCl2等)
不溶性杂质(泥砂等)
(2)粗盐的初步提纯
①溶解(玻璃棒的作用:搅拌、加速溶解)
②过滤(玻璃棒的作用:引流)
(注意过滤的操作要点)
③蒸发(玻璃棒的作用:搅拌、防止液滴飞溅)
④转移计算产率(玻璃棒的作用:把固体转移到纸上)
活动与探究:粗盐的提纯
蒸发的注意事项:
①蒸发皿应放在铁圈上,用酒精灯加热;
②加热过程中,要用玻璃棒不断搅拌,以防液滴飞溅;
③当蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干。
(3)粗盐进一步提纯的方法
①用化学方法将杂质MgCl2、CaCl2反应除去;
②用饱和NaCl溶液洗涤。
二、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、碳酸钙(CaCO3)
碳酸钠(Na2CO3)
碳酸氢钠(NaHCO3)
碳酸钙(CaCO3)
俗名
纯碱、苏打
小苏打
石灰石,大理石的主要成分
物理性质
白色粉末,易溶于水
白色晶体,易溶于水
白色固体,难溶于水
用途
用于玻璃、造纸、纺织和洗涤剂的生产等;蒸制馒头
焙制糕点的发酵粉;用于治疗胃酸过多的药剂
重要的建筑材料;补钙剂;实验室制取CO2
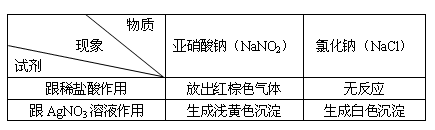
例1、某市发生了一起亚硝酸钠中毒事件。亚硝酸钠外观酷似食盐,有咸味,加热会分解,放出有臭味的气体,请结合下表信息判断,以下区别亚硝酸钠和氯化钠的方法错误的是( )
A.滴加稀盐酸 B.加热
C.品尝味道 D.滴加硝酸银溶液
答案:C
例2、在你所熟悉的盐中选出适当的填空。(写化学式)
(1)大量用于建筑工业上的是________;
(2)可用在玻璃、造纸、洗涤剂等工业上的是________;
(3)可作调味品的是________;
(4)可作补钙剂的是________;
(5)医疗上治疗胃酸过多的是________。
答案:
(1)CaCO3;
(2)Na2CO3;
(3)NaCl;
(4)CaCO3;
(5)CaCO3、NaHCO3。
小结:
一、氯化钠(NaCl)
1、NaCl的用途
2、粗盐提纯
二、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)、碳酸钙(CaCO3)
- 返回 -