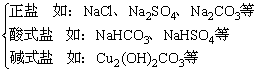| 盐的性质 |
主讲: 化学高级教师 舒宝生
复习:复分解反应
1、定义:两种化合物互相交换成分,生成另外两种化合物的反应叫做复分解反应。
2、复分解反应的种类
3、复分解反应的条件
AB+CD
AD+CB
有酸可不溶,无酸须都溶生成气体或沉淀或水都行
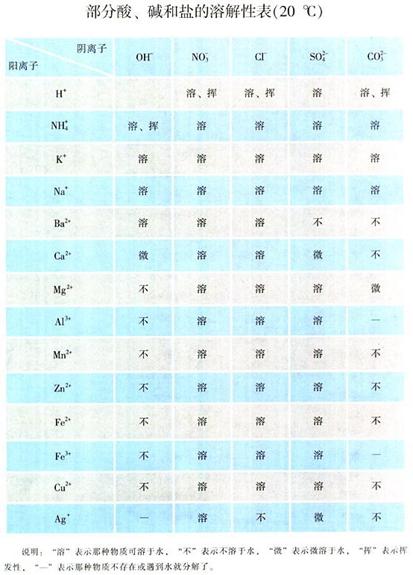
一、部分酸、碱和盐的溶解性
酸:初中范围内的酸全溶。
碱:钾、钠、钡、铵四碱溶,Ca(OH)2微溶,其余全不溶。
盐:(1)钾盐、钠盐、铵盐、硝酸盐全溶。
(2)盐酸盐:氯化银不溶,其余的全溶。
(3)硫酸盐:硫酸钡不溶,硫酸钙、硫酸银微溶,其余全溶。
(4)碳酸盐:K2CO3、Na2CO3、(NH4)2CO3易溶,MgCO3微溶,其余全不溶。
(5)碳酸氢盐易溶。
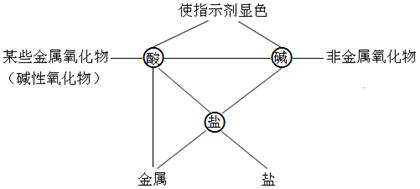
二、盐的化学性质
1、可溶性盐与某些活泼金属反应
注意:金属的活动性顺序
Cu+2AgNO3=Cu(NO3)2+2Ag(置换反应)
Fe+CuSO4=FeSO4+Cu(置换反应)
2、盐与酸反应生成新盐和新酸(注意复分解反应发生的条件)
HCl+AgNO3=AgCl↓+HNO3
H2SO4+BaCl2=BaSO4↓+2HCl
CaCO3+2HCl=CaCl2+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
注意:BaSO4、AgCl既不溶于水,也不溶于HCl、H2SO4、HNO3等酸。
3、可溶性盐与可溶性碱反应生成新碱和新盐。(注意:复分解反应发生的条件)
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH (工业制烧碱)
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4(产生蓝色沉淀)
FeCl3+3NaOH=Fe(OH)3↓+3NaCl (产生红褐色沉淀)
MgCl2+2NaOH=Mg(OH)2↓+2NaCl (产生白色沉淀)
4、可溶性盐与可溶性盐反应生成另外两种盐。
注意:复分解反应发生的条件
NaCl+AgNO3=AgCl↓+NaNO3
BaCl2+Na2SO4=BaSO4↓+2NaCl
知识归纳:
酸的通性
碱的通性
盐的性质
三、盐溶液的酸碱性
演示:Na2CO3溶液使酚酞溶液变色,使pH试纸变色。
呈酸性的盐,如:NH4Cl
呈碱性的盐,如:Na2CO3
呈中性的盐,如:NaCl
四、盐的分类及命名
1、分类
(1)按金属离子或酸根离子分类
(2)按组成分类
注意:与盐溶液的酸碱性不同
2、命名
(1)正盐:某化某:NaCl、CaCl2
某酸某:Na2CO3、Na2SO4
(2)酸式盐:某氢化某:如:NaHS
某酸氢某:如:NaHCO3、NaHSO4
(3)碱式盐:在正盐的名称前加上“碱式”二字
总结:
一、部分酸碱盐的溶解性
二、盐的化学性质
三、盐溶液的酸、碱性
四、盐的分类和命名
- 返回 -