5、实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)猜想
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
则CaO与水反应的反应方程式为________________________________________。
(2)实验:如下图所示:
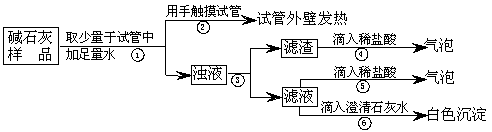
(3)判断:
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ__________(填:成立、不成立)
b.操作④发生化学反应的方程式为____________________;由操作⑤⑥的现象判断:滤液中含有__________(写化学式);由此判断猜想Ⅰ__________(填:成立、不成立)。
c.综合a和b的结论,判断该样品变质情况为____________________。
(4)拓展:由上述实验说明,实验室中“碱石灰”应__________保存;操作③中玻棒的作用是________________________________________。
[答案]
6、某活动小组的同学查阅资料得知,传统腌制松花蛋的主要配料是氧化钙、纯碱和食盐。小组同学将这三种物质混合后加入适量的水搅拌、过滤得滤渣和滤液,对滤液中溶质的成分进行探究:
猜想与假设:
甲同学认为:可能是NaCl、Na2C03、Ca(OH)2
乙同学认为:可能是NaCl、NaOH、Na2C03
丙同学认为:可能是NaCl、NaOH、Ca(OH)2
丁同学认为:可能是NaCl、NaOH
交流与评价:经过讨论,大家一致认为__________同学的猜想不合理。理由一是_________________;理由二是_______________________________
活动与探究:乙同学取原滤液向其中倾倒一定量的稀盐酸观察到有大量气泡产生,于是得出该滤液中的溶质是NaCl、NaOH、Na2C03的结论,证实了自己的猜想。丙同学取原滤液向其中加入Na2C03溶液无现象,据此否定了自己的猜想;他又重新取原滤液,向其中加入CaCl2溶液观察到_________________,得出了和乙同学相同的结论。丁同学为了验证上述结论也取原滤液向其中滴加了少量稀盐酸,却发现无气泡产生。
解释与结论:大家经过分析找出了丁同学所用试剂与乙同学相同,却没有看到气泡的原因。你认为可能的原因是_______________________________________。经过上述四位同学的共同努力,大家终于对滤液中溶质的成分得出了正确结论。
[答案]
7、小明同学欲通过实验证明“二氧化锰是氯酸钾受热分解的催化剂”这一命题。他设计并完成了下表所示的探究实验:
| |
实验操作 |
实验现象 |
实验结论或总结 |
各步骤结论 |
总结 |
实验一 |
将氯酸钾加热至融化,伸入带火星的木条, |
木条复燃 |
氯酸钾受热分解产生氧气,但是____________________。
反应的化学方程式为:____________________。 |
二氧化锰是氯酸钾受热分解的催化剂 |
实验二 |
加热二氧化锰,伸入带火星的木条, |
木条不复燃 |
二氧化锰受热不产生氧气。 |
实验三 |
______________
______________ |
木条迅速复燃 |
二氧化锰能加快氯酸钾的分解 |
(1)请你帮小明同学填写上表中未填完的空格;
(2)在小明的探究实验中,实验一和实验二起的作用是__________;
(3)小英同学认为仅由上述实验还不能完全得出表内“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是:____________________;第二方面的实验是要____________________。
[答案]
8、某研究性学习小组在实验中发现:不仅碱溶液可以使酚酞溶液变红,Na2CO3溶液也能使酚酞溶液变红。碱溶液可以使酚酞溶液变红,是因为碱在水溶液中解离出了OH-,那么Na2CO3溶液中究竟是哪种粒子可以使酚酞溶液变红呢?他们设计了下图3个实验,请你和他们一起探究。
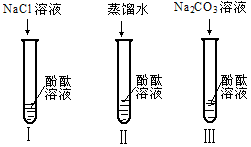
(1)实验Ⅰ可以证明________________________________________。
(2)实验Ⅱ加入蒸馏水的目的是____________________。小组内有同学认为实验Ⅱ没必要做,你认为他们的理由是。
(3)实验Ⅲ滴入Na2CO3溶液,振荡,酚酞溶液变红,向变红后的溶液中再逐渐滴入过量的CaCl2溶液,红色逐渐消失,同时还观察到__________现象。由实验Ⅰ、Ⅱ、Ⅲ得出结论: CO32-可以使酚酞溶液变红。
(4)小组同学在与老师交流上述结论时,老师说:“其实Na2CO3溶液能使酚酞溶液变红也是由于溶液中存在
OH-。”你认为Na2CO3溶液存在OH-的原因是____________________。
[答案]
9、期末化学实验老师整理药品时,拿出一瓶久置的氢氧化钙粉末[Ca(OH)2],他让小刘和小赵对这瓶氢氧化钙粉末的组成进行实验探究。
(1)提出问题:这瓶氢氧化钙是否已经生成碳酸钙(CaCO3)而变质?
(2)进行猜想:
A:氢氧化钙全部变为碳酸钙;B:氢氧化钙部分变为碳酸钙;C:氢氧化钙没有变质。
(3)设计实验方案、进行实验:下表是对猜想A进行实验探究的过程示例:
实验步骤 |
实验现象 |
实验结论 |
取样,加适量水,搅拌,过滤
①取少量滤液于试管中,滴入酚酞试液
②取少量滤渣于试管中,加入盐酸 |
①滤液不变色
②有气泡产生 |
氢氧化钙全部
变为碳酸钙 |
请你另选择一种猜想参与探究,完成下表。
实验步骤 |
实验现象 |
实验结论 |
取样,加适量水,搅拌,过滤
①取少量滤液于试管中,滴入酚酞试液
②取少量滤渣于试管中,加入盐酸 |
①
|
|
② |
(4)原理与用途:
①氢氧化钙俗称____________________,农业上一般采用氢氧化钙改良__________性土壤(选填“酸”或“碱”)。
②氢氧化钙变质是由于与空气中的__________发生反应的缘故,反应的化学方程式是:____________________,因此氢氧化钙应__________保存。
[答案]
10、同学们一起探究铝、铁、铜三种金属的活动性,小刚同学设计了用铜丝、铁丝、铝丝和稀盐酸,只用一只试管,取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题。
(1)填表
实验步骤 |
观察到的现象 |
①试管中取少量盐酸,插入铁丝,充分作用。 |
|
②在①所得的溶液中,插入__________,充分作用。 |
无明显现象 |
③在②所得的溶液中插入__________,充分作用。 |
|
结论:金属活动性Al>Fe>Cu
(2)将铝丝插入前应进行的操作是______________________________;
(3)小华同学认为在小刚设计的方案中,只要补充一个实验,就可得出Al>Fe>H>Cu的结论。小华要补充的实验是______________________________;
(4)小强同学认为要得到Al>Fe>H>Cu的结论,不必做补充实验,中需将小明同学方案中插入金属的顺序调整即可,你认为调整后插入金属的顺序是__________。
[答案]
11、小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究。
(1)为研究鱼塘中大量气泡是何种气体所致,小强使用如图所示的装置进行实验,打开分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是__________。由此可知养鱼师傅向鱼塘中撒过氧化钙的目的是____________________,仪器a的名称是____________________。
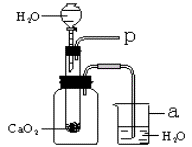
(2)根据质量守恒定律,小强认为过氧化钙与过量水反应还应产生某种含有钙元素的产物。开始小强假设该产物为CaO,但通过思考他很快否定了原先的假设,并重新假设生成的含钙产物为Ca(OH)2。请解释小强否定原假设建立新假设的理由:____________________。
请设计一个实验方案来验证小强的新假设,并填入下表空格中:
实验步骤 |
可能出现的现象 |
结论 |
| |
|
CaO2与H2O反应有Ca(OH)2生成 |
| |
CaO2与H2O反应无Ca(OH)2生成 |
(3)小强通过实验证明了过氧化钙与水反应的确有氢氧化钙生成,请写出过氧化钙和水反应的化学方程式:_____________________________________。
(4)小强在实验时观察到烧杯中有气泡产生,由此他还得出了什么结论__________________________________。
[答案]
12、实验室有一保管不当的试剂瓶,其残缺的标签中只剩下“Na”字样。已知它是无色液体,是初中化学常用的无机试剂。小宏同学为探究其成分进行了猜想,并设计实验进行验证,有关内容见下表:
猜想 |
设计的实验步骤 |
可能的现象与结论 |
猜想一:可能是氢氧化钠溶液 |
用试管取少量样品,向其中滴入两滴酚酞试液。 |
若酚酞试液变为红色,则猜想成立。
若酚酞试液无明显变化,则猜想不成立。 |
猜想二:? |
用试管取少量样品,向其中先滴入适量的用硝酸酸化的硝酸钡溶液,然后滴入硝酸银溶液。 |
若溶液先没有明显变化,后出现白色沉淀,则猜想成立。若与上述现象不同,则猜想不成立。 |
猜想三:? |
用试管取少量样品,向其中先加入适量盐酸酸化,然后滴入氯化钡溶液。 |
若溶液先没有明显变化,后出现白色沉淀,则猜想成立。若与上述现象不同,则猜想不成立。 |
请你参与这一探究活动,根据上表回答下列问题:
(1)小宏的猜想二是:____________________________________。如果猜想成立,则产生沉淀的化学反应方程式为_______________________________。
(2)小宏的猜想三是:____________________________________。如果猜想成立,则产生沉淀的化学反应方程式为_________________________________。
(3)小宏同学对猜想一所描述的实验现象和作出的结论是否正确?请判断并说明理由。
_________________________________________________________________________。
(4)除了小宏的三种猜想,请你再补充一种猜想,模仿上述过程,设计简单的实验方案并验证你的猜想,将有关内容填入下表。
[答案]
13、请根据图示回答下列问题:
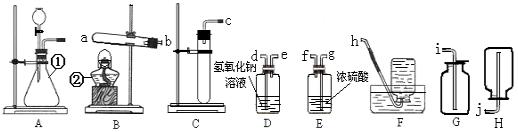
(1)写出图中标号的仪器名称:①____________________,②____________________;
(2)实验室欲用高锰酸钾制取氧气,应选择的气体发生装置是__________,产生氧气的化学方程式为________________________________________;
(3)已知过氧化钠(Na2O2)是一种淡黄色固体,常温下可与水反应生成氢氧化钠和氧气。如果在实验室中用A装置作气体发生装置,用过氧化钠和水反应来制取一瓶干燥的氧气,所选装置的正确连接顺序是(填写管口字母)a→___________。若只改变A装置中的药品,仍采用已连接的整套装置,还可以用来制取的气体是_____________。
(4)通过上述两种制取氧气的方法所选用发生装置的对比,你觉得选择气体发生装置应考虑的因素是____________________;
(5)装置A和C都可以作为实验室制取同种气体的发生装置,A和C相比,具有哪些优点?(只答出一条即可)____________________。
[答案]
14、松花皮蛋是我们喜爱的食品。某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2CO3)等。同学们对料泥进行了如下探究:
猜想:猜想I:料泥的主要成份是Ca(OH)2、NaOH、KOH、CaCO3、灰份;
猜想Ⅱ:料泥的主要成份是NaOH、KOH、Na2CO3、CaCO3、灰份。
实验与现象:实验过程与现象如下图:
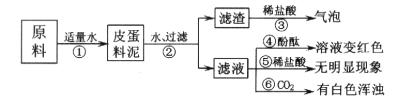
问题与讨论:
(1)步骤②中所需要的玻璃仪器有:烧杯、玻璃棒、________,玻璃棒在步骤②中的一种作用______________。
(2)步骤③的现象说明滤渣中含有:__________(写化学式)。
(3)请写出步骤①发生的任意两个反应的化学方程式:____________________、_____________________。
(4)由上述实验现象推断,猜想_________是正确的,其理由是__________________。
[答案]
15、复习时,常用专题探究的方法学习常见物质的组成、性质与制取,课堂上老师引导我们回顾了几个探究实验。
探究1:研究常见物质组成
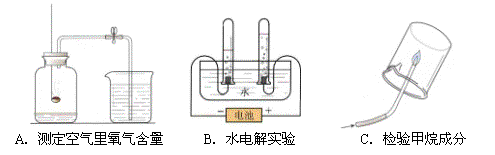
A、B、C都是研究物质组成的实验。从研究方法得知,A实验是利用可燃物消耗瓶内的__________,使瓶内压强减小来推测空气里氧气含量的。B实验是通过证明生成物的_____________来推断水的组成的。而C实验与__________(填实验代号)实验的方法相同。
探究2:研究常见物质性质——氢氧化钠与硫酸是否刚好完全中和
(1)探索:用玻璃棒蘸取反应后的溶液滴在pH试纸上,发现该溶液的pH<7,说明硫酸过量。
(2)验证:
实验内容 |
实验现象 |
解释与结论 |
取反应后少量溶液于试管中,______ |
____________ |
证明研究结论正确 |
写出(2)出中涉及的化学方程式_______________________________。
探究3:研究常见物质制取——制取氢氧化钠溶液
小京同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
小欢同学却说:“这种无色溶液中不一定含有氢氧化钠。”他提出了如下实验:
实验步骤 |
实验现象 |
实验结论 |
用试管取无色溶液少许,滴入2滴无色酚酞试液 |
无色酚酞试液变红 |
无色溶液中含有
氢氧化钠 |
小妮认为小欢的实验方案也不严密,不能证实无色溶液中一定含有氢氧化钠,理由是____________________________________。
[答案]
16、实验室有一瓶久置的氢氧化钠固体,红旗课外活动小组同学决定对此进行探究。
第一小组同学提出猜想:该试剂是否变质,该组同学积极讨论,提出三种探究方案即加入三类不同试剂,分别进行实验,得出相同结论:试剂已变质。则这三种方案中所加入的试剂分别为__________、__________、__________。
第二小组同学得知第一小组的实验结论,决定进行如下课题研究:该样品中碳酸钠的质量分数为多少?于是采用下列装置测定样品中碳酸钠的质量分数。
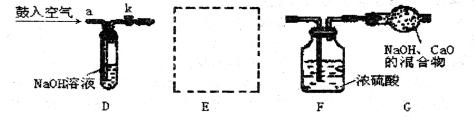
实验操作过程如下:把准确称量的10克样品装入E装置后,将E装置分别与装置D和F相连,打开开关K,从a处缓缓鼓入空气几分钟后,将开关K关闭,再将已称量过的干燥管G与装置F连接,然后将足量稀H2SO4缓缓注入E装置的瓶中。待反应完全后,再次打开开关K缓缓鼓入空气几分钟,最后称量干燥管G,增重了3.3克。请回答:
(1)为顺利完成该小组的实验探究,请你帮该小组选择:上图中的E装置可选用下图中哪一装置? __________(填装置序号);若实验室采用同样的装置制取氧气,其制取原理是(用化学方程式表示)________________________________________。
(2)D装置的作用是__________________________________________________。
(3)由干燥管G增加的质量,可推算出样品中Na2CO3的质量分数是__________。
(4)反应前第一次鼓入空气的作用是____________________,若反应后不鼓入空气,对测定结果的影响是__________。(填“偏大”或“偏小”)。
第三小组同学也想对此瓶固体进行探究,苦于没有不同的研究课题。请你帮助该小组确定一个与前面不同的研究课题:____________________。
[答案]
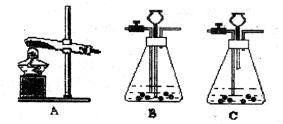
17、(Ⅰ)实验室常用下列装置制取气体,我能根据所学知识回答下列问题。
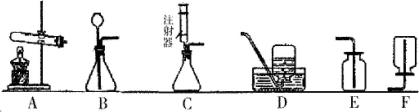
(1)用A装置制取某种气体的一个化学方程式为____________________。
(2)实验室用过氧化氢溶液和二氧化锰粉末混合制取氧气,我不选B而选用C做气体发生装置,其优点是______________________________。
(3)汽车尾气中的一氧化氮是一种大气污染物。它是一种无色气体,难溶于水,密度比空气略大,在空气中能与氧气迅速反应生成红棕色的二氧化氮气体。实验室中制取一氧化氮采用的收集装置是(填序号)__________。
我认为选择气体收集方法,从气体性质的角度需要考虑的因素是:____________________________。
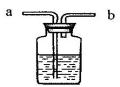
(4)在医院里给病人输氧时,在氧气钢瓶和病人吸氧器之间连接一个类似下图所示的装置,在装置中盛放大约半瓶蒸馏水,导气管__________(填“a”或“b”)端连接在供氧气的钢瓶上,该装置的作用有(填写一条) ______________________________。
(Ⅱ)刘丽同学在某食品包装袋内取出一小袋干燥剂,上面写着“干燥剂,主要成分为生石灰”。她将这袋干燥剂全部倒入一定量水中,充分搅拌后过滤,得到白色沉淀和滤液。
(1)刘丽同学测定了滤液的酸碱度,你认为结果可能是__________。
(2)刘丽同学又对白色沉淀的组成提出了以下假设:
假设l是CaO和CaCO3的混合物
假设2是Ca(OH)2和CaCO3的混合物
假设3只有CaCO3
假设4只有Ca(OH)2
其中假设__________不合理。
(3)为了判断其他几种假设的合理性,刘丽同学继续进行实验:
①取少量沉淀放在试管中,加人稀盐酸,出现气泡,该反应的化学方程式为:_________________________由此可否定假设__________。
②为了得到最后结论,她再取少量沉淀放在另一支试管中,加少量水振荡、静置后,滴入酚酞试液,显红色,说明只有假设__________合理。