(一)溶液
1、概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物叫做溶液。
2、溶液的基本特征:均一性、稳定性、混合物
注意:(1)溶液不一定无色
(2)某溶液中溶质的种类可以只一种,也可以是两种或两种以上
(3)溶液的质量=溶质的质量+溶剂的质量
溶液的体积≠溶质的体积+溶剂的体积
(4)溶质可以是固体、液体或气体;水是最常用的溶剂

4、溶解时放热、吸热现象
溶解吸热:如NH4NO3溶解(扩散过程中吸收热量>水合过程中放出热量)
溶解放热:如NaOH、浓H2SO4溶解(溶解扩散过程中吸收热量<水合过程中放出热量)
溶解没有明显热现象:如NaCl(扩散过程中吸收热量≈水合过程中放出热量)
(二)饱和溶液、不饱和溶液
1、概念:
(1)饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时所得到的溶液,叫做这种溶质的饱和溶液。
(2)不饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质还能继续溶解时所得到的溶液,叫做这种溶质的不饱和溶液。
2、判断方法:看有无不溶物或继续加入该溶质,看能否溶解
3、饱和溶液和不饱和溶液之间的转化

注:Ca(OH)2和气体等除外
4、结晶
(1)概念:已溶解在溶液中的溶质以晶体的形式析出,这一过程叫做结晶。
(2)结晶方法:①蒸发结晶;②冷却结晶
(三)溶解性:一种物质(溶质)溶解在另一种物质(溶剂)里的能力称为溶解性。
①不同的物质在同一溶剂中溶解性不同。如常温下高锰酸钾易溶于水,而碘不易溶于水。
②同一种物质在不同溶剂中的溶解性不同。如常温下碘不易溶于水,却易溶于汽油。
(四)溶解度
1、固体的溶解度
(1)定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
四要素:①条件:一定温度 ②标准:100g溶剂 ③状态:达到饱和 ④单位:克
(2)溶解度的含义:
20℃时NaCl的溶液度为36g的含义:
在20℃时,在100克水中最多能溶解36克NaCl。
或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克。
(3)影响固体溶解度的因素:①溶质、溶剂的性质(或种类)②温度

(4)溶解度曲线
①表示某物质在不同温度下的溶解度或溶解度随温度变化的趋势。
②溶解度曲线上的每一个点表示溶质在某温度下的溶解度,溶液必然是饱和溶液。
③两条曲线交叉点表示两种溶质在同一温度下具有相同的溶解度。
④在溶解度曲线下方的点,则表示溶液是不饱和溶液。
⑤在溶解度曲线上方靠近曲线的点表示过饱和溶液。
2、气体的溶解度
(1)气体溶解度的定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
(2)影响因素:
①气体的性质
②温度(温度越高,气体溶解度越小)
③压强(压强越大,气体溶解度越大)
3、溶解性和固体溶解度的关系
溶解性 |
易溶 |
可溶 |
微溶 |
难溶 |
20℃的溶解度/g |
大于10 |
1~10 |
0.01~1 |
小于0.01g |
(五)溶质的质量分数
1、公式: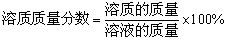
在饱和溶液中: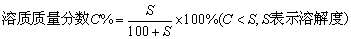
2、配制一定溶质质量分数的溶液
(1)用固体配制:
①步骤:计算、称量、溶解
②仪器:天平、药匙、量筒、滴管、烧杯、玻璃棒
(2)用浓溶液稀释(稀释前后,溶质的质量不变)
①步骤:计算、量取、稀释
②仪器:量筒、滴管、烧杯、玻璃棒
3、浓、稀溶液与饱和、不饱和溶液之间的关系
①饱和溶液不一定是浓溶液,如饱和的石灰水溶液就是稀溶液
②不饱和溶液不一定是稀溶液
③在一定温度时,同一种溶质的饱和溶液一定要比它的不饱和溶液浓
(六)乳浊液、乳化作用
小液滴分散到液体里形成的混合物叫做乳浊液(不稳定,分层)。能够促使两种互不相溶的液体形成稳定乳浊液的物质叫做乳化剂。乳化剂所起的作用称为乳化作用。如:
洗涤剂对植物油有乳化作用,它能使植物油分散成无数细小的液滴,而不能聚集成大的油珠。
例1、下图是同学们经常使用的某品牌修正液包装标签。小明仔细阅读后,结合自己的生活经验和所学知识得出了该修正液的某些性质。下面小明的推测中不合理的是( )。

A.修正液是一种溶液,均一、透明
B.修正液中含有的化学物质有毒
C.修正液的成分对纸张不具有腐蚀性
D.修正液的溶剂易挥发、易燃烧
解析:
从修正液使用前摇匀,可知修正液不是均一的,所以不是溶液。
答案:A
例2、20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是( )
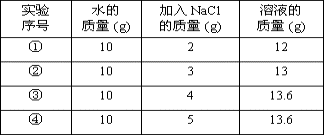
A.②中所得溶液是饱和溶液
B.20℃时10g水最多能溶解4g NaCl
C.③④溶液的溶质质量分数相等
D.①所得溶液的溶质质量分数为20%
解析:
从表格中的数据可知:20℃时,10克水中能溶解NaCl 3.6克,③④都是饱和溶液,溶质的质量分数相等
答案:C
例3、A图表示的是硝酸钾和氢氧化钙的溶解度随温度变化的情况。B图中甲、乙试管分别盛有硝酸钾和氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管中的固体减少,乙试管中的固体增加,则加入的物质不可能是( )
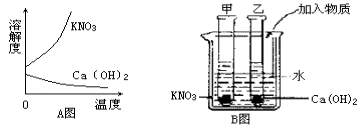
A.浓硫酸 B.氢氧化钠
C.氧化钙 D.氯化钠
解析:
向烧杯中加入一种物质后,甲试管中的固体减少,乙试管中的固体增加,根据溶解度随温度变化的情况知:加入的物质溶于水应放热或与水反应放热,浓硫酸、氢氧化钠溶于水都放热,氧化钙与水反应放热。
答案:D
例4、下图是X、Y两种固体物质的溶解度曲线。下列说法中正确的是( )
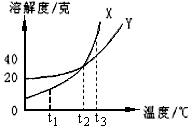
A.t1℃时X的溶解度大于Y的溶解度
B.t2℃时X的溶解度等于Y的溶解度
C.t3℃时X的饱和溶液降温至t2℃时,变为不饱和溶液
D.t1℃时Y的不饱和溶液升温至t2℃时,变为饱和溶液
解析:
t1℃时X的溶解度小于Y的溶解度;t3℃时X的饱和溶液降温至t2℃时,会析出晶体,仍为饱和溶液;t1℃时Y的不饱和溶液升温至t2℃时,溶解度增大,仍为不饱和溶液。
答案:B
例5、下图中M、N分别表示二种固体物质(不含结晶水)的溶解度曲线,试根据图中曲线判断下列说法正确的是( )
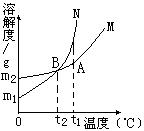
A.图中A点表示M、N二种物质在t1℃时均达到饱和
B.M、N二种饱和溶液,当温度从t1降至t2时,一定析出相同质量的晶体
C.同处A点的相同质量的M、N二种溶液,当温度从t1降至t2 后,剩余溶液的质量分数相等
D.0℃时,M、N具有相同的溶解度
解析:
图中A点表示M这种物质在t1℃时均达到饱和,但N这种物质在t1℃时为不饱和溶液;M、N二种饱和溶液,当温度从t1降至t2时,都会析出晶体,尽管N的溶解度降低比M多,但两种溶液的总量不知道谁大,所以M、N二种溶液谁析出晶体的质量大是无法比较的;0℃时, N的溶解度显然比M的溶解度小。
答案:C
例6、向20℃的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是( )
A.溶液温度末冷却到20℃时,溶液一定是饱和溶液
B.溶液温度末冷却到20℃时,溶质质量分数比甲溶液大
C.溶液温度恢复到20℃时,溶液质量比甲溶液小
D.溶液温度恢复到20℃时,溶液的溶质质量分数和甲溶液的相等
解析:
氧化钙和水反应生成氢氧化钙,而且放热。由于氢氧化钙的溶解度随温度的升高而减小,溶液温度末冷却到20℃时,溶液中还要析出氢氧化钙,溶质质量分数比甲溶液小。
答案:B