|
一周强化
一、一周知识概述
(一)反应热
1、概念:在化学反应过程中放出或吸收的热量,通常叫做反应热。
反应热用符号△H表示,单位一般采用kJ/mol
2、放热反应和吸热反应的比较。
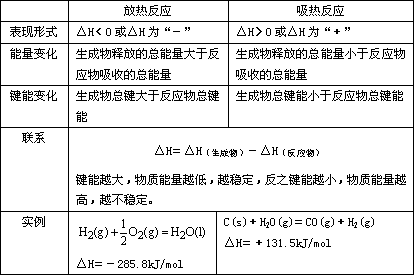
(二)热化学方程式
1、概念:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。
2、表示意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。例如:
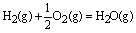 ;△H=-241.8kJ/mol ;△H=-241.8kJ/mol
表示1mol气态H2与(1/2)mol气态O2反应生成1mol水蒸气,放出241.8kJ的热量。
(三)燃烧热
1、概念:在101kPa时,1mol物质燃烧生成稳定的氧化物的时所放出的热量,叫做该物质的燃烧热。燃烧热的单位一般用kJ/mol表示。
2、注意:必须以1mol可燃物燃烧为标准;可燃物必须完全燃烧,生成稳定化合物。例如:1mol碳燃烧生成CO时放出的热不是燃烧热,CO不稳定,可继续燃烧生成CO2。
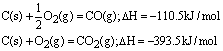
C的燃烧热为393.5kJ/mol而不是110.5kJ/mol。
3、表示的意义:例如C的燃烧热为393.5kJ/mol,表示在101kPa时,1molC完全燃烧放出393.5kJ的热量。
4、书写热化学方程式:燃烧热是以1mol物质完全燃烧所放出的热量来定义的,因此在书写它的热化学方程式时,应以燃烧1mol物质为标准来配平其余的化学计量数。例如
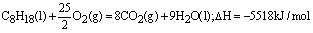
即C8H18的燃烧的热为5518kJ/mol。
(四)中和热
1、概念:在稀溶液中,酸跟碱发生中和反应而生成1mol H2O,这时的反应热叫中和热。
2、注意:必须以生成1mol水为标准;中和反应对象为稀溶液;强酸与强碱中和时生成1mol H2O均放热57.3kJ,弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。
3、中和热的表示:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol。
二、重难点知识讲解
(一)热化学方程式的书写
与普通化学方程式相比,书写热化学方程式除了要遵循书写化学方程式的要求外还应注意以下五点:
1、△H只能写在标有反应物和生成物状态的化学方程式的右边,并用“;”隔开。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为kJ/mol。
2、注意反应热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是在25℃、101325Pa下测定的,可不注明温度和压强。
3、注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子或原子数。因此化学计量数可以是整数、也可以是分数。
4、注意反应物和产物的聚集状态不同,反应热△H不同。因此,必须注明物质的聚集状态才能完整地体现出热化学方程式的意义。气体用“g”,液体用“l”,固体用“s”,溶液用“aq”。热化学方程式中不用↑和↓。
5、注意热化学方程式是表示反应已完成的数量。由于△H与反应完成物质的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应向逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
例如:已知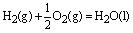 ;△H=-285.8kJ/mol,则 ;△H=-285.8kJ/mol,则
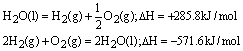
(二)盖斯定律及其应用
化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步及反应的反应热之和与该反应一步完成的反应热是相同的,这就是盖斯定律。
例如:
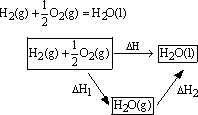
可以通过两种途径来完成。如上图表:已知:
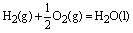 ; ;
△H1=-241.8kJ/mol
H2O(g)=H2O(l);
△H2=-44.0kJ/mol
根据盖斯定律,则
△H=△H1+△H2=-241.8kJ/mol+(-44.0kJ/mol)=-285.8kJ/mol
其数值与用量热计测得的数据相同。
三、典型例题
例1、在同温同压下,下列各组热化学方程式中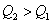 的是( ) 的是( )
A.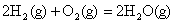 ; ;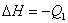
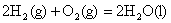 ; ;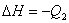
B.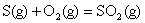 ; ;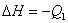
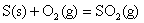 ; ;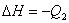
C.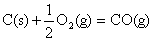 ; ;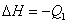
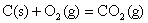 ; ;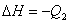
D.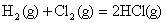 ; ; 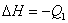
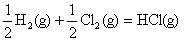 ; ;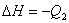
答案:选AC
解析:
反应根据热化学反应方程特性来分析此问题。①首先分析同一物质不同聚集状态转化时的能量变化。例如:A中因 放热、故 放热、故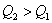 ;B中 ;B中  吸热,而且S在燃烧时必须由固态变为气态才能燃烧。故 吸热,而且S在燃烧时必须由固态变为气态才能燃烧。故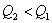 ;②其次分析化学计量数对反应热的影响,例如:D中 ;②其次分析化学计量数对反应热的影响,例如:D中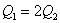 ,故 ,故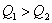 ;③再分析不同物质在反应中相互关系及对反应热的影响。例如:C中C不完全燃烧生成CO,而CO还可以继续燃烧放出热量,故 ;③再分析不同物质在反应中相互关系及对反应热的影响。例如:C中C不完全燃烧生成CO,而CO还可以继续燃烧放出热量,故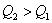 。 。
点评:本题主要考查反应热和热化学方程式的相关知识。
例2、已知下列热化学方程式:
(1)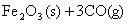 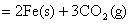 ; ;
△H=-25 KJ/mol
(2)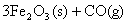 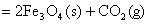 ; ;
△H=-47 KJ/mol
(3)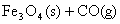 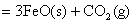 ; ;
△H=+19 KJ/mol
写出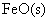 被CO还原成Fe和CO2的热化学方程式______________。 被CO还原成Fe和CO2的热化学方程式______________。
答案: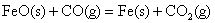 ;△H=-11 KJ/mol ;△H=-11 KJ/mol
解析:
依据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热量是相同的。我们可从题目中所给的有关方程式分析:从方程式(3)与方程式(1)可看出有我们需要的有关物质。但方程式(3)必须通过方程式(2)有关物质才能和方程式(1)结合在一起。
将方程式(3)×2+方程式(2);可表示为(3)×2+(2)
得: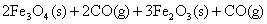
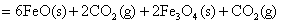
△H=+19 KJ/mol×2+(-47KJ/mol)
整理得(4):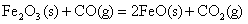
△H=-3 KJ/mol
将(1)-(4)得 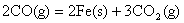 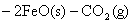
△H=-25 KJ/mol-(-3 KJ/mol)
整理得: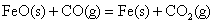 ;△H=-11 KJ/mol ;△H=-11 KJ/mol
点评:本题考查热化学方程式的写法和反应热的计算。
- 返回 -
|