(一)烷烃
1、烷烃(也叫饱和链烃)的概念、结构特点及通式[CnH2n+2(n≥1)]
2、烷烃的性质
(1)物理性质:
烷烃的熔、沸点随着分子里碳原子数增加而升高。在室温下C1—C4的烷烃为气态。碳原子数相同的烷烃,支链越多,熔沸点越低。
(2)化学性质:
烷烃性质稳定,在通常状况下与强酸、强碱和酸性KMnO4溶液不反应。但易发生以下两种反应。
取代反应: 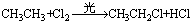 (可进一步取代)
(可进一步取代)
氧化反应: 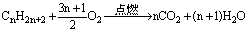
(二)乙烯的化学性质
1、氧化反应
(1)燃烧

乙烯气体在空气中燃烧的爆炸极限为 3.4%—34%,因此点燃前需验纯。
乙烯在燃烧时,火焰比甲烷的要明亮,并有黑烟,这是因为乙烯中碳的质量分数比甲烷中碳的质量分数高,燃烧时碳并没有完全被氧化,而本身被烧成炽热状态,所以乙烯的火焰很明亮,又由于有一部分碳呈现游离态,所以有黑烟冒出。
(2)被强氧化剂氧化
5CH2=CH2+12KMnO4+18H2SO4→10CO2+6K2SO4+12MnSO4+28H2O
(可使酸性 KMnO4溶液褪色)
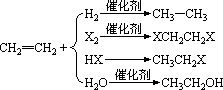
2、加成反应
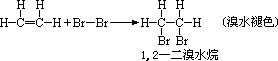
加成反应的外延是不饱和有机物之间的反应或不饱和有机物跟其它物质之间的反应,因此加成反应不同于一般的化学反应,在中学化学里,常见的与乙烯发生的加成反应有:
3、聚合反应
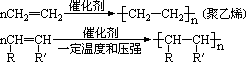
(三)烯烃
1、概念:链烃分子里含有C=C的不饱和烃。
2、单烯烃通式:CnH2n(n≥2)
3、烯烃的性质
(1)物理性质

(2)化学性质
结构相似,化学性质相似,同乙烯相似 a、氧化反应;b、加成反应;c、加聚反应。
(注意:不对称烯烃与 HX等极性化合物的加成规律:氢原子加到含氢多的C=C双键的碳原子上,可称之为“氢多加氢”。)
(四)乙炔的实验室制法
1、反应原理:CaC2+2H2O→CH≡CH↑+Ca(OH)2
2、可用排水法收集乙炔气体,一般不用排空气法收集,因为C2H2的密度略小于空气。
3、注意事项:
(1)电石和水反应很剧烈,为得到平稳的乙炔气流,可用饱和食盐水代替水,并选用分液漏斗控制水流的速度。
(2)制取乙炔气体不能用启普发生器,因为:a.电石跟水反应生成Ca(OH)2溶解度较小,容易沉积在容器底部而堵塞球形漏斗下端管口。b.碳化钙与水反应很剧烈,不易控制。c.反应过程中放出大量的热,易使启普发生器炸烈。
(3)工业上生产电石用下面的反应:
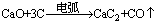
这样制得的 CaC2往往含有CaS、Ca3P2,因此制得的乙炔气体往往含有H2S、PH3等而有臭味。
(五)乙炔的化学性质
1、氧化反应
(1)可燃性:
(2)与酸性KMnO4反应,使酸性KMnO4褪色。
2、加成反应
(1)与Br2的CCl4溶液反应
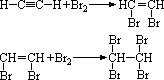
还可以与溴水反应发生加成反应。
(2)与其它物质反应:
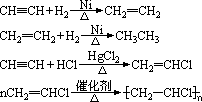
(六)炔烃
1、炔烃的通式为CnH2n-2,这与二烯烃的通式相同
2、炔烃的性质
四个碳以下的炔烃为气态烃,炔烃的熔沸点、密度随着碳原子数的增加而升高,炔烃分子中含有叁键,与乙炔的性质相似,可以发生氧化反应和加成反应。
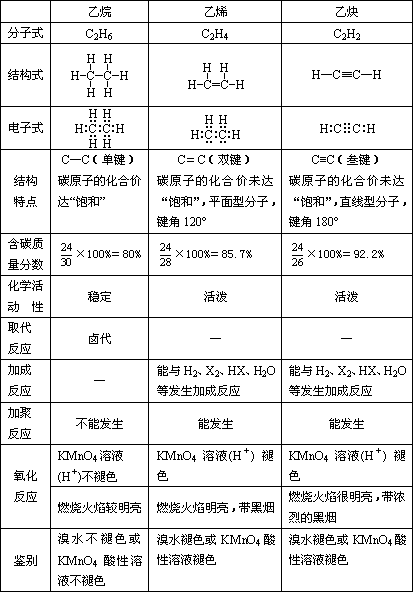
(七)乙烷、乙烯、乙炔分子结构和化学性质的比较