(一)、有机物分子式确定的一般方法
1.根据各元素原子个数确定分子式
通过测定有机物中各元素的质量分数,再结合有机物的相对分子质量,可以确定有机物中各元素的原子个数,从而写出分子式。即由气态有机物密度或相对密度或其他条件→求摩尔质量(相对分子质量)→求1mol分子中所含各元素原子的物质的量→求分子式。
例1、实验测得某烃A中含碳85.7%,含氢14.3%。在标准状况下11.2L此化合物气体的质量为14g。求此烃的分子式。
解析:
(1)求该化合物的摩尔质量
根据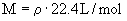 得
得
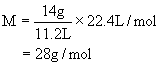
(2)求1mol该物质中碳和氢原子的物质的量
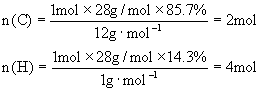
即1mol该化合物中含2molC原子和4molH原子,故分子式为C2H4。
评注:确定相对分子质量的方法:
(1)由气体在标准状况下的密度求相对分子质量:
M=p(标准状况)×22.4
(2)由气体的相对密度求相对分子质量:同温同压下,1LA气体的质量为mA,1LB气体的质量为mB,则A对B的相对密度为:d(A对B)=mA/mB
样品A的相对分子质量为:M(A)=d(A对B)×M(B)
2.利用最简式和相对分子质量确定分子式
通过测定有机物中各元素的质量分数(或元素的质量比),确定有机物的最简式(实验式),再依据有机物的相对分子量来确定分子式。即由各元素的质量分数→求各元素的原子个数之比(实验式)→相对分子质量→求分子式。
例2、实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式。又测得该化合物的相对分子质量是30,求该化合物的分子式。
解析:
(1)求化合物的实验式即是求该化合物分子中各元素原子的数目(N)之比。
N(C)∶N(H)=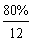 ∶
∶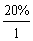 =1∶3
=1∶3
该化合物的实验式是CH3。
(2)设该化合物分子式为(CH3)n,则:
n=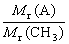 =
=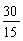 =2
=2
该化合物的分子式是C2H6。
答案:该碳氢化合物的实验式是CH3,分子式是C2H6。
3.利用有机物燃烧通式和相对分子质量确定分子式。
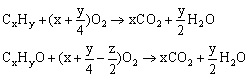
由于x、y、z相对独立,借助通式进行计算,解出x、y、z,最后求出分子式。
例3、某有机物的蒸气密度是相同状况下甲烷密度的3.625倍,把1.16 g该有机物在氧气中充分燃烧,将生成的气体混合物通过足量碱石灰,碱石灰增重3.72 g,又知生成H2O和CO2物质的量之比为1∶1。求此有机物的分子式。
解析:
Mr=16×3.625=58
∴ n=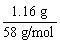 =0.02 mol
=0.02 mol
CxHyOz+(x+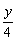 -
-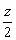 )O2
)O2 xCO2 +
xCO2 + 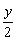 H2O
H2O
1 mol x mol 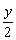 mol
mol
0.02 mol 0.02x mol 0.01y mol
依题意:0.02 x=0.01 y 2x=y
0.02 x×44+0.01y×18=3.72
解得:x=3 y=6
3×12+6+16z=58 z=1
∴ 分子式为C3H6O
答案:C3H6O
小结:确定有机物分子式的基本途径:
(二)、计算推断分子式有三种方法
1、基本方法
先根据测得的气体密度计算气体的摩尔质量,然后计算 1mol气态有机物中各元素原子的物质的量,最后确定该气体有机物的分子式。
2、最简式法
根据已知先求出摩尔质量,再据质量分数求出碳氢原子个数比,然后找到最简式式量与相对分子质量的关系,最后确定分子式。
3、商余法
根据碳氢化合物中对其相对分子质量碳、氢原子的影响大小,用碳相对原子质量除以相对分子质量,所得商的整数部分就是烃分子中所含碳原子数的最大值,而余数就是氢原子数的最小值。
(三)、有机物燃烧规律
1、等质量的烃完全燃烧时,氢的含量越大,消耗的O2的量就越多。
2、等物质的量有机物完全燃烧时,耗氧量的多少由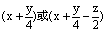 决定。
决定。
3、在100℃以上时,烃CxHy完全燃烧时,当y=4时,燃烧前后体积不变;当y>4时,燃烧后的体积大于燃烧前的体积;当y<4时,燃烧后的体积小于燃烧前的体积。
4、当组成混合物的各组分的含碳质量分数相等时,则产生二氧化碳的量与各组分的含量无关,而只与混合物的总质量有关。
5、当组成混合物的各物质的含氢质量分数相等时,则产生的水的量与各组分的含量无关,只与混合物的总质量有关。
6、多种有机物任意比混合,只要其物质的量不变,完全燃烧时,生成的CO2或H2O的物质的量不变,则它们分子式中的碳原子数相同或氢原子数相等。
(四)、确定有机物结构式的常见方法
1、根据有机物的性质确定有机物的类别或所含有的官能团。
(1)既不能使溴水褪色,又不能使酸性KMnO4溶液褪色的烃为烷烃或苯;
(2)既能使溴水褪色,又能使酸性KMnO4溶液褪色的烃为不饱和烃(烯烃或炔烃)。
(3)不能使溴水褪色,但能使酸性KMnO4溶液褪色的烃为苯的同系物。
(4)能与金属钠反应放出氢气的有机物中一定含有羟基。
2、根据有机物的定量实验或其取代物的种类来确定该有机物的结构式。