|
一周强化
【考试说明】
了解元素原子核外电子排布的周期性与元素性质递变关系,重点掌握典型非金属在周期表中的位置及与其性质的关系。了解其他常见非金属元素的单质及其化合物。
卤族元素——典型的非金属
(1)以氯为例,了解卤族元素的物理性质和化学性质。
(2)从原子的核外电子排布,理解卤族元素(单质、化合物)的相似性和递变性。
(3)掌握氯气的化学性质,了解几种重要的含卤素化合物的性质和用途。
[导读]这部分内容是历年高考重点考查的内容之一,大家一定要掌握典型非金属元素的物理、化学性质及其化合物的性质、用途等。
其他常见的非金属元素(如:H、O、S、N、P、C、Si)
(1)了解这些元素的单质及某些氧化物、氢化物的性质。
(2)以Na2O2为例,了解过氧化物的性质。
(3)掌握硫酸、硝酸的化学性质。
(4)以硫酸为例,了解化工生产化学反应原理的确定。初步了解原料与能源的合理利用、“三废利用”与环境保护以及生产过程中的综合经济效益问题。
(5)了解常见盐类的性质和用途。
(6)初步了解常见化肥的基本性质。
(7)了解硫、氮、碳的氧化物对大气的污染及其防治。
(8)初步了解氟氯烃、含磷洗涤剂及二氧化硅粉尘对环境及人类健康的影响。
(9)初步了解一些生活用水的净化及污水处理的基本原理。
[导读]硫酸、硝酸的化学性质,原料与能源的合理利用,生产过程中的综合经济效益问题是这部分的重点。
【知识网络】
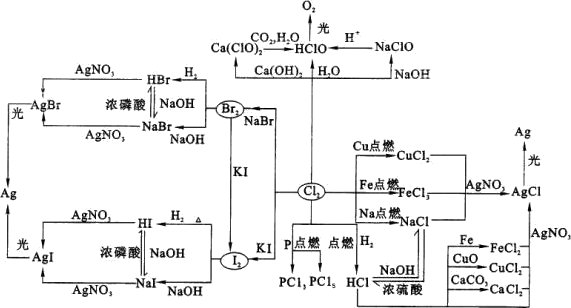
1、卤素及其重要化合物的相互转化
例1、已知:
①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。
②X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是________________、Z是________________。
(2)写出③中反应的化学方程式:____________________________。
(3)写出④中反应的化学方程式:_____________________________。
解析:
已知条件③可以作为解决本题的突破口。常见的一元强碱,应该考虑为KOH和NaOH。和碱作用的单质A,可以从金属单质和非金属单质两个方面去分析。金属单质与碱反应,则是两性的金属,如Zn、Al等。产物是AlO2-或 ,很难同时生成含有这种金属元素的两种化合物。而考生熟知的非金属单质,如卤素单质Cl2、Br2和I2等却都可以在碱中发生歧化反应,得到一种卤化物和一种卤素的含氧酸盐,还有硅可与强碱溶液反应,但它只生成硅酸的一种含硅化合物。 ,很难同时生成含有这种金属元素的两种化合物。而考生熟知的非金属单质,如卤素单质Cl2、Br2和I2等却都可以在碱中发生歧化反应,得到一种卤化物和一种卤素的含氧酸盐,还有硅可与强碱溶液反应,但它只生成硅酸的一种含硅化合物。
如何判断是KOH还是NaOH呢?如何判断是Cl2,是Br2还是I2呢?从条件①中给出的原子序数将会起决定性作用,但在此之前,还必须判断出一元强碱的金属元素是Y还是Z。④中含卤素的化合物D受热分解会制得元素Y的单质,这种单质显然不会是金属钠或金属钾。钠和钾金属的制取绝对不会用热分解含卤化合物的方法。故碱中的金属元素是Z。
若元素X是Br,则金属元素是钾和钠均不合题意,因其原子序数都小于Br。故元素X是氯,于是可以同时确定金属元素Z是钾。
由条件④中制单质Y的反应,以催化分解KClO3最典型。Y应是氧元素,因此Y、X、Z应分别是O、Cl、K。
由条件③的歧化反应之一是B或C中含有氧元素,D中亦含有氧元素,因此Y是氧元素是最合理的。D又不是高氯酸钾,因为题设D中X不显最高化合价。
答案:
(1)Cl(或氯)K(或钾)
(2)Cl2+2KOH KCl+KClO+H2O KCl+KClO+H2O
(3)2KClO3 2KCl+3O2↑ 2KCl+3O2↑
练习1、下列物质在一定条件下可实现图中所示的一系列变化。其中固体W的焰色反应呈紫色,A是一切生物都不能缺少的气体。
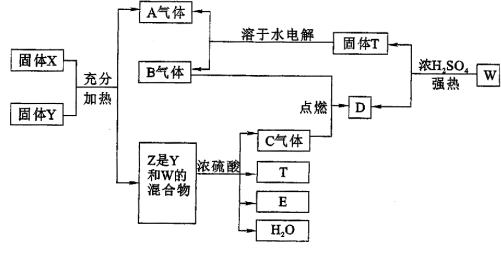
请回答:
(1)判断X、Y各是什么物质?X________________Y________________
(2)写出有关反应的化学方程式:
①Z+H2SO4(浓)→C
②W+H2SO4(浓)→D+T
答案:
(1)KClO3,MnO2
(2)①4KCl+MnO2+2H2SO4(浓) Cl2↑+MnCl2+2K2SO4+2H2O Cl2↑+MnCl2+2K2SO4+2H2O
②2KCl+H2SO4(浓) 2HCl↑+K2SO4 2HCl↑+K2SO4
2、硫及其重要化合物的相互转化
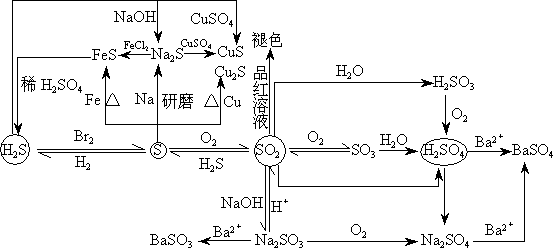
例2、A、B、C、D、E分别代表5种微粒,每种微粒中都含有18个电子。其中A和C都是由单原子形成的阴离子,B、D和E都是分子;又知在水溶液中A跟B反应生成C和D;E具有强氧化性。请回答:
(1)用化学符号表示上述5种微粒:
A________________,B________________,C________________,
D________________,E________________。
(2)在水溶液中A跟B反应的离子方程式是__________________。
解析:
题中“每种微粒中都含有18个电子”是最主要前提,我们解题时,将常见18电子的微粒列出:K+、Ca2+、Cl-、S2-、HS-、Ar、F2、HCl、H2S、H2O2等。在其中寻找符合条件的粒子,例如“单原子形成的阴离子” 仅有Cl-、S2-,具有强氧化性的有F2、H2O2,然后利用由于在水溶液中A(Cl-或S2-)+B(分子)→C(Cl-或S2-)+D(分子) 仅有Cl-、S2-,具有强氧化性的有F2、H2O2,然后利用由于在水溶液中A(Cl-或S2-)+B(分子)→C(Cl-或S2-)+D(分子) ,即可推出各种相应微粒。 ,即可推出各种相应微粒。
答案:(1)S2-,HCl,Cl-,H2S,F2(或H2O2)
(2)S2-+2H+ H2S↑ H2S↑
例3、下图是中学化学中常见的物质间化学反应关系的图示,其中A的焰色反应呈黄色,E、F为有刺激性气味的气体,G为强酸性溶液,H为既难溶于水、也难溶于稀酸的白色固体。
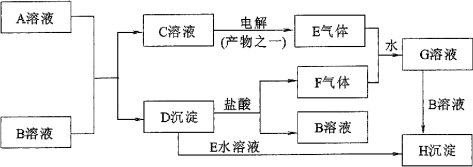
试回答:
(1)写出化学式:A________________;B________________。
(2)写出下列反应的离子方程式:
①C→E:________________________________;
②D→H:________________________________;
③E+F+H2O→G:________________________________。
解析:
常见有刺激性气味的气体有Cl2、SO2、NO2等。E气体是C溶液的电解产物之一,且E有刺激性气味,可知E是Cl2,C溶液中含Cl-。 F气体也有刺激性气味,且F能在溶液中与Cl2反应生成强酸性的G溶液,则F是SO2,G是H2SO4和HCl的混合溶液。D沉淀能与盐酸反应生成B溶液和SO2,则D溶液是亚硫酸盐。因沉淀H为既难溶于水、 F气体也有刺激性气味,且F能在溶液中与Cl2反应生成强酸性的G溶液,则F是SO2,G是H2SO4和HCl的混合溶液。D沉淀能与盐酸反应生成B溶液和SO2,则D溶液是亚硫酸盐。因沉淀H为既难溶于水、 也难溶于稀酸的白色固体,D沉淀加氯水生成沉淀H,则H是BaSO4,D是BaSO3,B是BaCl2。A的焰色反应呈黄色,可知A中含Na+。含Na+的A溶液与BaCl2溶液反应,生成BaSO3沉淀和C溶液,则A是Na2SO3,C是NaCl。NaCl溶液的电解产物之一是有刺激性气味的气体Cl2。 也难溶于稀酸的白色固体,D沉淀加氯水生成沉淀H,则H是BaSO4,D是BaSO3,B是BaCl2。A的焰色反应呈黄色,可知A中含Na+。含Na+的A溶液与BaCl2溶液反应,生成BaSO3沉淀和C溶液,则A是Na2SO3,C是NaCl。NaCl溶液的电解产物之一是有刺激性气味的气体Cl2。 符合题意。 符合题意。
答案:
(1)A:Na2SO3 B:BaCl2
(2)①2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑
②BaSO3+Cl2+H2O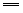 BaSO4↓+2H++2Cl- BaSO4↓+2H++2Cl-
③SO2+Cl2+2H2O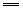 4H++2Cl-+SO42- 4H++2Cl-+SO42-
练习2、溶液①由A、B两种正盐组成,它与其他物质间有如下的转化关系:
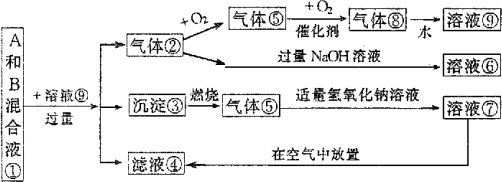
(1)写出下列反应的离子方程式:⑦~④_________________;
②~⑥_________________________________________。
(2)溶液①中两溶质可能有多种组合,将其可能的化学式及其物质的量nA、nB之间应满足的关系填入下表(有几种情况填几种,可不填满,也可补充)。
答案:
(1)2SO32-+O2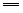 2SO42-;H2S+2OH- 2SO42-;H2S+2OH-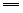 S2-+2H2O S2-+2H2O
(2)A填Na2S,B填Na2SO3;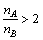 ; ;
A填Na2S,B填Na2S2O3;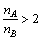 。 。
3、氮族元素及其化合物的相互转化:
一、氮及其重要化合物
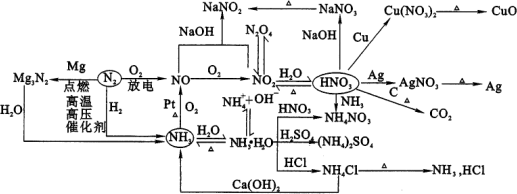
二、磷及其重要化合物
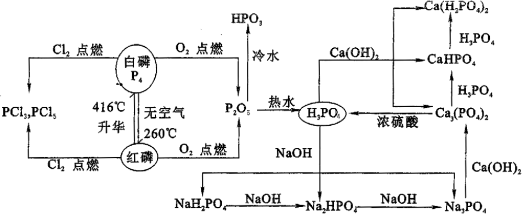
例4、下图为短周期元素组成的中学常见A~J十种物质的转换关系。已知A、B、C、D均为单质,通常状态下单质A、C、D为气态B为固态。它们在一定条件下可发生如下列框图所示的化学反应,得到E~J等化合物(图中物质的状态均为常温常压下的状态)。
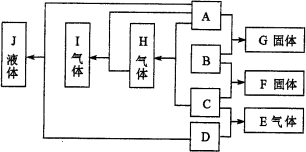
有关反应的化学计量关系为:
①A与B按物质的量之比n(A)︰n(B)=1︰2完全反应生成G
②B与C按物质的量之比n(B)︰n(C)=3︰1完全反应生成F
③C与D按物质的量之比n(C)︰n(D)=1︰3完全生成E
请填空:
(1)构成上述物质各元素的离子中,电子层结构相同且按其离子半径由大到小排列的顺序是(用离子符号表示)_________________。
(2)物质G的电子式是______________,其化学键类型是_________________。
(3)B和C反应生成F的化学方程式为_________________。
(4)实验室制取E反应的化学方程式_________________,干燥E时常用干燥剂的名称是_________________。
(5)室温下将F投入J可生成E和一种白色难溶物X,该反应的化学方程式为_________________;若将I通入J中可生成H和某物质Y,X与Y溶液可发生中和反应,该反应的离子方程式为__________________。
答案:
(1)N3->O2->Mg2+
(2)Mg2+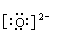 离子键 离子键
(3)3Mg+N2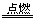 Mg3N2 Mg3N2
(4)2NH4Cl+Ca(OH)2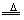 CaCl2+2NH3↑+2H2O (碱石灰) CaCl2+2NH3↑+2H2O (碱石灰)
(5)Mg3N2+6H2O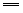 3Mg(OH)2↓+2NH3↑ 3Mg(OH)2↓+2NH3↑
Mg(OH)2+2H+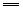 Mg2++2H2O Mg2++2H2O
练习3、图中1~分别代表有关反应中的一种物质,请填写以下空白:
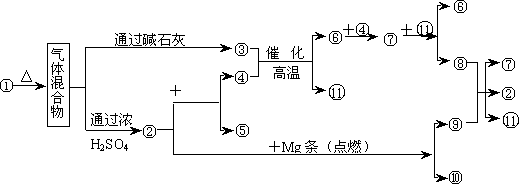
(1)①、③、④的化学式分别是____________、_________、____________。
(2)⑧与⑨反应的化学方程式是__________________________________。
答案:
(1)NH4HCO3;NH3;O2
(2)C+4HNO3(浓) 4NO2↑+CO2↑+2H2O 4NO2↑+CO2↑+2H2O
4、碳硅及其重要化合物
例5、在25℃,101kPa条件下,将15L O2通入10L CO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中
V(CO)= _________________L,V(H2)= _________________L。
(2)若剩余气体的体积为aL,则原CO和H2的混合气中V(CO)︰V(H2)= ____________。
(3)若剩余气体的体积为aL,则a的取值范围是_________________。
解析:
本题主要考查计算推理能力,涉及的两个燃烧反应方程式如下:
2CO+O2 2CO2 2H2+O2 2CO2 2H2+O2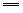 2H2O(1) 2H2O(1)
仔细审视这两个方程式的化学计量数可知:
(1)无论是CO或H2,它们燃烧所需要O2的物质的量都只是自己的一半
(2)燃烧前的CO和燃烧后的CO2的物质的量是相等的,因此其体积是不变的。但是燃烧前的H2的体积在燃烧后是不计的。
据此,代入题设数据可知:
(1)10L CO和H2的混合气,充分燃烧只需要5L O2,题给15L,将多余10L。
如果剩余气体为15L,则必定还有CO2,它来源于CO,它们的体积应是:
V(CO2)=V(CO)=(15-10)L=5L
因此H2的体积应是V(H2)=(10-5)L=5L
(2)剩余气体为aL,其中有O2 10L,所以CO2应是(a-10)L,CO2来自CO。
V(CO)=V(CO2)=(a-10)L
V(H2O)=10L-(a-10)L=(20-a)L
V(CO)︰V(H2)=(a-10)︰(20-a)
(3)剩余气体为aL,其中必含O2 10L,因此a>10.
又因为,氧气实际消耗(15-10)L,两种气体合计共为10L,如果全部是H2,则剩余气体只有O2应该是10L;如果全部是CO,则剩余气体还有10L的CO2,全部剩余气体应该是V(O2)+V(CO2)=10L+10L=20L
即a的取值范围是10L≤aL≤20L
如果,原料气指定是混合气则10<a<20
答案:
(1)5,5
(2)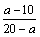
(3)10<a<20
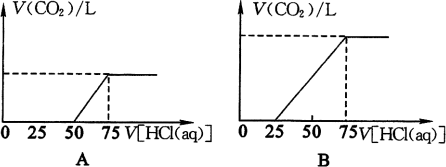
练习4、取等物质的量浓度的NaOH溶液两份,两份均为50mL,向其中各通入一定量的CO2,随后分别各取溶液10mL,将其稀释成100mL,并分别向稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加盐酸的体积之间的关系如下图所示(设分别为A、B两种情况)
回答下列问题:
(1)在(A)情况下,溶质为(写化学式)____________________________,其物质的量之比为_________________,在标准状况下通入CO2气体的体积为_________________。
(2)在(B)情况下,溶质为(写化学式)_________________,其物质的量之比为_________________,在标准状况下通入CO2气体的体积为_________________。
(3)原NaOH溶液的物质的量浓度为__________________________________。
答案:
(1)NaOH,Na2CO3;1︰1;280mL
(2)Na2CO3,NaHCO3;1︰1;560mL
(3)0.75mol/L
附:
1、卤素(单质、化合物)的相似性、递变性
(1)相似性:
①单质均为双原子非极性分子;
②主要化合价为-1价,最高正价为+7价(氟除外);
③强氧化性。
(2)递变性: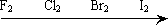
①原子半径和离子半径增大
②非金属性与单质氧化性减弱
③与H2化合或与水反应由易到难
④氢化物稳定性减弱
⑤最高价氧化物的水化物酸性减弱
⑥卤离子还原性增强
⑦前面元素的单质能把后面元素置换出来
⑧单质颜色变深,熔沸点升高
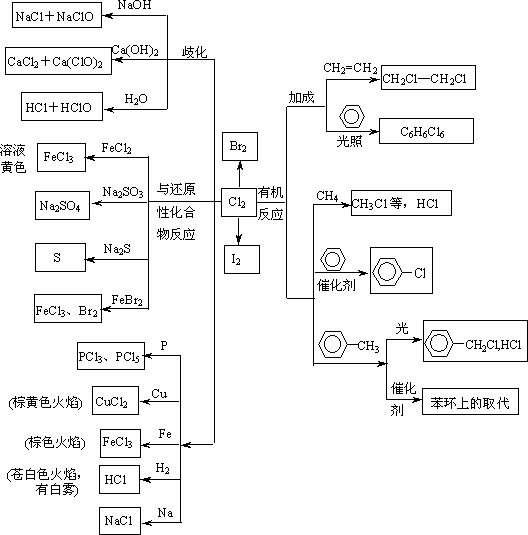
2、Cl2的化学性质
3、H2SO4、HNO3的化学性质
(1)硫酸的化学性质
浓H2SO4是氧化性酸,稀H2SO4是非氧化性酸,H2SO4无论是浓的还是稀的都具有酸的通性,由于浓硫酸中含有大量未电离的硫酸分子,故还具有特性:
1、吸水性:吸收游离的水分
H2SO4+nH2O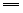 H2SO4·nH2O(n=1,2,4等) H2SO4·nH2O(n=1,2,4等)
浓H2SO4可干燥O2、H2、CO、CO2、SO2、Cl2、HCl、N2、CH4等气体,而不能干燥碱性气体(如NH3),还原性气体(如H2S、HBr、HI)。
2、脱水性:将有机物中的H、O按2︰1的比例脱去。
3、强氧化性:可氧化大多数金属(除Pt、Au)和其他还原性物质(如H2S、HBr、HI、Fe2+、C等)
Cu+2H2SO4(浓)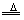 CuSO4+SO2↑+2H2O(氧化性、酸性) CuSO4+SO2↑+2H2O(氧化性、酸性)
C+2H2SO4(浓)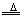 CO2↑+SO2↑+2H2O(氧化性) CO2↑+SO2↑+2H2O(氧化性)
在以上反应中,浓H2SO4一般被还原为SO2。常温下,Al、Fe在浓H2SO4中钝化,也是浓H2SO4强氧化性的表现。
此外,浓H2SO4在某些有机反应中,可作催化剂、脱水剂、磺化剂等。
(2)HNO3的化学性质
(1)强酸性(具有酸的通性)
稀硝酸使石蕊试液变红色,浓硝酸使石蕊试液先变红(H+作有),后褪色(强氧化作用,即漂白作用)。用此实验可以证明浓硝酸的氧化性比稀硝酸强。
(2)不稳定性:4HNO3 4NO2↑+O2↑+2H2O 4NO2↑+O2↑+2H2O
由此反应可推知下列事实:
①浓硝酸一般呈黄色,是由于硝酸分解产生的NO2溶于硝酸的缘故。
②硝酸浓度越大越易分解,因此,浓硝酸应放入棕色瓶中(避光)、阴凉处保存(避免受热分解),用玻璃塞(酸会腐蚀橡皮塞)而不能用橡皮塞。
③强氧化性(HNO3中+5价N有很强的得电子能力):
硝酸不论浓、稀都是氧化性的酸。硝酸和金属或非金属单质反应规律如下:
①金属和硝酸反应,不论金属活泼与否,不论硝酸浓度大小,一般无氢气放出。这是因为H+夺得电子的能力不及硝酸中+5价氮元素夺电子的能力。
②在金属活动顺序表中、排在氢以后的较不活泼的金属和硝酸反应,如果是浓硝酸,则还原产物是NO2,如果是稀硝酸,还原产物是NO,金属则氧化成相应的硝酸盐。要对金属和硝酸反应进行定性和定量的分析。
Cu+4HNO3(浓)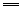 Cu(NO3)2+2NO2↑+2H2O(实验室制NO2) Cu(NO3)2+2NO2↑+2H2O(实验室制NO2)
3Cu+8HNO3(稀)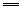 3Cu(NO3)2+2NO↑+4H2O(实验室制NO) 3Cu(NO3)2+2NO↑+4H2O(实验室制NO)
③室温下浓硝酸使铁、铝钝化。(发生了化学反应)
④浓硝酸和浓盐酸按物质的量之比为1︰3组成的混合物叫王水,王水能溶解铂和金:
3Pt+4HNO3(浓)+18HCl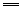 3H2PtCl6+4NO↑+8H2O 3H2PtCl6+4NO↑+8H2O
Au+HNO3(浓)+4HCl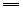 HAuCl4+NO↑+2H2O HAuCl4+NO↑+2H2O
⑤非金属和浓硝酸反应,非金属被氧化成最高价氧化物或最高价氧化物对应的水化物,如:
4HNO3(浓)+C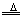 2H2O+4NO2↑+CO2↑ 2H2O+4NO2↑+CO2↑
6HNO3(浓)+S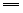 H2SO4+6NO2↑+2H2O H2SO4+6NO2↑+2H2O
5HNO3(浓)+P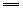 H3PO4+5NO2↑+H2O H3PO4+5NO2↑+H2O
4、离子的检验:

例6、某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出气体可以使湿润的红色石蕊试纸变蓝;
③加入氯水后,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br- B.SO42-
C.H2SO4 D.NH4+
解析:
加热时放出的气体可以使品红溶液褪色,则溶液中一定含有H2SO3,因H2SO3不稳定,分解产生的SO2可使品红溶液褪色。加碱加热后,产生使润湿的红色石蕊试纸变蓝的气体为NH3,说明溶液中有NH4+。加入氯水时溶液显黄色,说明有Br-,而生成的不溶于HNO3的沉淀BaSO4,不能确定是原溶液含有SO42-,还是H2SO3被Cl2氧化生成SO42-。
答案:B
练习5、溶液A可能含有等物质的量浓度的Cl-、AlO2-、S2-、SiO32-、SO32-、CO32-、SO42-、PO43-离子中的几种。现进行如下实验:
①取5mL A溶液,往其中通入足量CO2,得到白色沉淀B。B能完全溶于盐酸;
②另取5mL A溶液,往其中加入盐酸,生成气体C,但不产生沉淀。将C通入CuSO4溶液,有黑色沉淀D生成。
根据以上实验回答:
(1)溶液A中肯定存在的离子有____________________________;
(2)溶液A中肯定不存在的离子有__________________________;
理由是_____________________________________________________
答案:
(1)AlO2-,S2-
(2)SiO32-,SO32-;AlO2-和SiO32-与碳酸反应生成的产物是Al(OH)3和H2SiO3,前者可溶于盐酸,而后者不行,所以应存在AlO2-而排除SiO32-; 加盐酸生成气体可能有下列几种情况:CO2或H2S或SO2或混合物,由于气体通入CuSO4溶液后有黑色沉淀生成, 加盐酸生成气体可能有下列几种情况:CO2或H2S或SO2或混合物,由于气体通入CuSO4溶液后有黑色沉淀生成, 说明肯定存在S2-而排除SO32-的存在,因为6H++2S2-+SO32- 说明肯定存在S2-而排除SO32-的存在,因为6H++2S2-+SO32- 3S↓+3H2O。 3S↓+3H2O。
- 返回 -
|