例1、氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
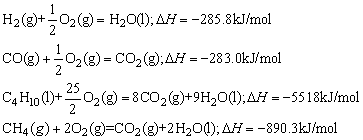
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是( )
A.H2(g) B.CO(g)
C.C8H18(l) D.CH4(g)
答案:B
解析:
由热反应方程式知:物质的量相同的H2、CO、C8H18(l),CH4燃烧时放热最少的是CO,当上述四种物质质量相同时,物质的量最小的是C8H18,其次是CO,它们的物质的量之比为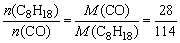 ,质量相同的CO与C8H18完全燃烧放出热量之比为: ,质量相同的CO与C8H18完全燃烧放出热量之比为: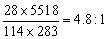 ,因此,放出热量最少的应是CO。 ,因此,放出热量最少的应是CO。
例2、已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l);△H=-4b kJ/mol
B.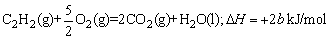
C.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l);△H=-2b kJ/mol
D.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l);△H=+b kJ/mol
答案:A
解析:
由ag C2H2完全燃烧生成1 mol CO2和液态水放出b kJ热量可知a g C2H2物质的量为0.5mol,据此可推断出1 mol C2H2完全燃烧生成2 mol CO2和液态水放热2 b kJ,则2 mol C2H2完全燃烧生成4 mol CO2和液态水放热4 b kJ,据此可知A正确。
例3、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )。
A.
B.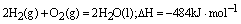
C.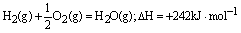
D.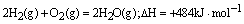
解析:
本题通过实验数据考查对热化学方程式的理解和书写。热化学方程式的书写要求与普通方程式的区别有三:①一定要标明各物质的状态。B选项中水为液态,排除;②计量系数可用分数小数表示其实际物质的量,且与热量成正比;③用△H表示时,吸热,其值为正;放热,其值为负。H2与O2反应生成水蒸气是放热反应,△H应为负值,则排除C、D。而其逆反应,△H则为正值。故选A。
答案:A
例4、已知2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol,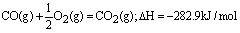 某H2与CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为( ) 某H2与CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2和CO的物质的量之比为( )
A.2:1 B.1:2
C.1:1 D.2:3
解析:
根据热化学方程式可知:H2燃烧热为571.6kJ/mol÷2=285.8kJ/mol,生成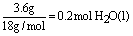 ,参加反应的H2为0.2mol,H2燃烧放出的热量为0.2mol×285.8kJ/mol=57.16kJ。 ,参加反应的H2为0.2mol,H2燃烧放出的热量为0.2mol×285.8kJ/mol=57.16kJ。
CO燃烧放出的热量为113.74KJ-57.6KJ=56.58KJ,CO的燃烧热282.9KJ/mol,故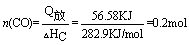 。 。
故H2和CO物质的量之比为0.2mol:0.2mol=1:1。
答案:C
|