| 高考第一轮化学
单元训练题十 化学反应速率 化学平衡
|
|
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共108分,考试时间100分钟。
可能用到的相对原子质量:H:1 C:12 O:16 N:14 S:32 Na:23 Cl:35.5
第Ⅰ卷(选择题,共46分)
一、选择题(本题包括8小题,每小题2分,共16分。每小题只有一个选项符合题意)
1、下列条件的变化,是通过降低反应所需要的能量,增加单位体积内反应物分子中活化分子的百分数而使反应速率加快的是( )
A.增大浓度 B.增大压强
C.升高温度 D.使用催化剂
2、对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是( ) 2SO3(g),能增大正反应速率的措施是( )
A.通入大量O2 B.增大容积
C.移去部分SO3 D.降低体系温度
3、在恒温恒容条件下,2NO+O2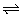 2NO2达到平衡的标志是( ) 2NO2达到平衡的标志是( )
①NO、O2、NO2分子数目比是2︰1︰2
②反应混合物中各组分物质的浓度相等
③混合气体的颜色不再变化
④混合气体的平均相对分子质量不变
A.①② B.①③
C.②③ D.③④
4、将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 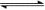 2HBr(g);△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。则a与b的关系是( ) 2HBr(g);△H<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。则a与b的关系是( )
A.a>b B.a=b
C.a<b D.无法确定
5、下列措施或事实不能用勒沙特列原理解释的是( )
A.实验室用排饱和食盐水的方法收集氯气
B.H2、I2、HI平衡混合气体加压后颜色变深
C.硫酸工业上SO2氧化成SO3,宜采用空气过量
D.合成氨反应常采用2×107~5×107Pa的高压下进行
6、对平衡CO2(g) CO2(aq);△H=-19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是( ) CO2(aq);△H=-19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
A.升温增压 B.降温减压
C.升温减压 D.降温增压
7、在一恒定的容器中充入2mol A和1mol B发生反应:2A(g)+B(g)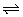 x C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为( ) x C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为( )
A.只能为2 B.只能为3
C.可能是2,也可能是3 D.无法确定
8、在一定条件下,可逆反应N2+3H2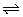 2NH3;△H<0,达到平衡后,当单独改变下述条件后有关叙述错误的是( ) 2NH3;△H<0,达到平衡后,当单独改变下述条件后有关叙述错误的是( )
A.加入催化剂,v正、v逆都发生变化,且变化的倍数相等
B.加压,v正、v逆都增大,且v正增大的倍数大于v逆增大倍数
C.降温,v正、v逆都减小,且v正减小倍数大于v逆减小倍数
D.增大c(N2),v正、v逆都增大,且v正增大倍数大于v逆增大倍数
二、(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得3分,但只要选错一个,该小题就为0分)
9、向某密闭容器中充入1mol CO和2mol H2O(g),发生反应: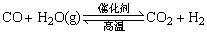 。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( ) 。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A.0.5mol CO+2mol H2O(g)+1mol CO2+1mol H2
B.1mol CO+1mol H2O(g)+1mol CO2+1mol H2
C.0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4mol H2
D.0.5mol CO+1.5mol H2O(g)+0.5mol CO2+0.5mol H2
10、一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)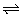 Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是( ) Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol·(L·s)-1
B.将容器体积变为20L,Z的平衡浓度变为原来的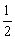
C.将容器体积变为5L,物质Y的转化率和浓度均增大
D.若升高温度,X的体积分数增大,则该反应正反应的△H>0
11、一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图10-1所示:
下列描述正确的是( )
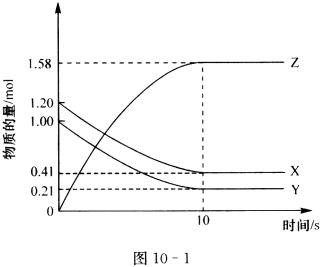
A.反应开始到10s,用Z表示的反应速率为0.158 mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10s,Y的转化率为79.0%
D.反应的化学方程式为: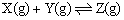
12、工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol·L-1的NaOH恰好反应
13、一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图10-2Ⅰ所示,隔板K不能移动)。下列说法正确的是(图10-2) ( ) 2C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图10-2Ⅰ所示,隔板K不能移动)。下列说法正确的是(图10-2) ( )
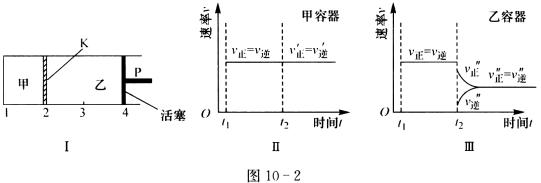
A.保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变.升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图10-2Ⅱ和图10-2Ⅲ所示(t1前的反应速率变化已省略)
14、两气体A、B分别为0.6mol与0.5mol,在0.4L密闭容器中发生反应3A+B mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间内D的平均反应速率为0.1mol·(L·min)-1,下面结论中正确的是( ) mC+2D,经5min后达到平衡,此时C为0.2mol。又知在此反应时间内D的平均反应速率为0.1mol·(L·min)-1,下面结论中正确的是( )
A.m的值为1
B.B的转化率为20%
C.A的平均反应速率为0.1mol·(L·min)-1
D.平衡时反应混合物总物质的量为1mol
15、将N2、H2以体积比1︰1混合均匀,分成三等份,分别充入甲、乙、丙三个装有相同催化剂且容积不变的真空密闭容器中,在相同温度下使其分别达到化学平衡。已知平衡时甲中N2的转化率为20%,乙中H2的转化率为30%,丙中混合气体的平均相对分子质量为16,则有关三容器内反应的叙述正确的是( )
A.起始时反应速率相同
B.平均反应速率的大小是甲>乙>丙
C.容器的容积由小到大的是丙<乙<甲
D.平衡时,NH3的体积分数丙中比甲中大
16、合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)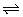 2NH3(g);△H<0.673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图10-3所示。下列叙述正确的是( ) 2NH3(g);△H<0.673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图10-3所示。下列叙述正确的是( )
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大
17、对于平衡体系:m A(g)+n B(g) p C(g)+q D(g);△H<0,有下列判断,其中正确的是( ) p C(g)+q D(g);△H<0,有下列判断,其中正确的是( )
A.若温度不变,将容器的容积增大1倍,此时A的浓度为原来的0.48倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,则说明反应开始时A、B的物质的量相等
C.若平衡体系中共有气体a mol,再向其中加入b mol B,当重新达到平衡时,气体总的物质的量等于(a+b)mol,则m+n=p+q
D.若反应在容积不变的密闭容器中进行,升高温度,重新达到平衡时体系压强减小,则m+n>p+q
18、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图10-4中P表示压强,T表示温度,n表示物质的量):
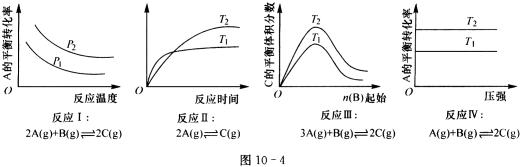
根据以上规律判断,上列结论正确的是( )
A.反应Ⅰ:△H>0,P2>P1
B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1
D.反应Ⅳ:△H<0,T2>T1
[提示]
第Ⅱ卷 (共62分)
三、(本题包括2小题,共13分)
19、(7分)在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到表1:
表1
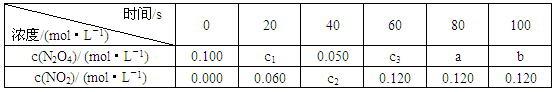
试填空:
(1)达到平衡时N2O4的转化率为__________%,表中c2__________c3,a__________b(填“>”、“<”、“=”)。
(2)20s时N2O4的浓度c1=________mol·L-1,在0~20s内N2O4的平均反应速率为__________mol·(L·s)-1。
(3)若在相同情况下,最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是__________mol·L-1。
(4)若在相同情况下再向密闭容器中充入0.100mol的N2O4气体,则达到平衡时N2O4的转化率__________(填“>”、“<”、“=”)原平衡时N2O4的转化率。
20、(6分)将各2a mol的P、Q、R、S在一密闭容器中混合,发生如下反应:
x P+y Q 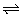 z R+w S 。 z R+w S 。
达到平衡后,测得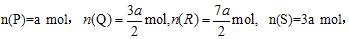
已知四种物质中只有R是固体。
(1)若该反应中物质的化学计量数x=2,则z=__________,w=__________。
(2)达到平衡时,P的转化率是__________。
(3)如果只改变压强,化学反应速率变化,但化学平衡不移动,则该反应中各物质的聚集状态分别是:Q__________,S__________。
(4)如果只升高温度,反应一段时间后,各物质的物质的量均变为2a mol,则该反应的正反应为__________热反应。
[答案]
四、(本题包括2小题,共16分)
21、(8分)在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通。容器中发生以下反应:N2+3H2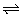 2NH3,正反应是放热反应。若达到平衡后,测得混合气体的体积为7体积,据此回答下列问题: 2NH3,正反应是放热反应。若达到平衡后,测得混合气体的体积为7体积,据此回答下列问题:
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,反应达到平衡时,各物质的百分含量与上述平衡时完全相同,那么:
①若a=1,c=2,则b=__________,在此情况下,反应起始时将向__________进行。
②若需规定起始时反应向逆反应方向进行,则c的范围是__________。
(2)在上述容器中,若需控制平衡后混合气体为6.5体积,则可采取的措施是__________。
22、(8分)t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)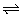 x C(g),2min时反应达到平衡状态(温度不变)剩余了0.8mol B,并测得C的浓度为0.4mol·L-1,请填写下列空白: x C(g),2min时反应达到平衡状态(温度不变)剩余了0.8mol B,并测得C的浓度为0.4mol·L-1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为__________。
(2)x=__________。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡(填字母)__________。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)= __________mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为_______________。
[答案]
五、(本题包括2小题,共16分)
23、(7分)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)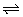 CH3OH(g)。图10-5所示为甲醇物质的量随时间和温度变化曲线。 CH3OH(g)。图10-5所示为甲醇物质的量随时间和温度变化曲线。
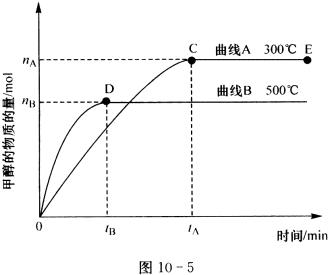
根据题意完成下列各题:
(1)反应达到平衡时,升高温度,平衡__________(填“向左”、“向右”、“不”)移动。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= __________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是__________。
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是____________________ (用化学方程式表示)。
24、(9分)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)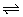 2SO3(g);△H<0。 2SO3(g);△H<0。
600℃时,将一定量SO2、O2、SO3的混合气体通入一个2L密闭容器中,反应过程中SO2、O2、SO3物质的量变化如图10-6所示。
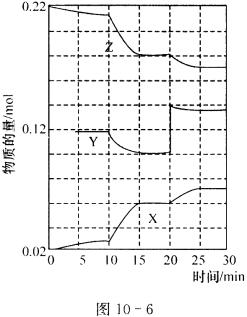
(1)图中共有三条曲线X、Y和Z,其中曲线__________表示O2物质的量随时间的变化。
(2)降低温度,二氧化硫转化率__________,化学反应速率__________ (以上均填“增大”、“减小”或“不变”)。
(3)前20min内用SO2表示的化学反应速率v(SO2)=__________mol·(L·min)-1。
(4)反应处于平衡状态的时间是____________________。
(5)据图判断,反应进行至20min时采取的措施是____________________。10min到15min的曲线变化的原因可能是__________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
[答案]
六、(本题包括2小题,共17分)
25、(9分)恒温下,将a mol N2和b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)。 2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%,计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整式比,下同)为:n(始)︰n(平)= __________。
(4)原混合气体中,a︰b=__________。
(5)达到平衡时,N2和H2的转化率之比为:α(N2)︰α(H2)= __________。
(6)平衡混合气体中,n(N)︰n(H2)︰n(NH3)= __________。
[答案]
26、(8分)在763K、3.04×104kPa时,用CO和H2作原料合成CH3OH,存在下列平衡:
CO(g)+2H2(g) CH3OH(g)。当原料中H2和CO的比例不同时,对CO的转化率及平衡混合物中甲醇的体积百分含量都有影响。 CH3OH(g)。当原料中H2和CO的比例不同时,对CO的转化率及平衡混合物中甲醇的体积百分含量都有影响。
(1)设H2和CO的起始物质的量之比为n,平衡时CO的转化率为a,平衡混和物中甲醇的体积百分含量为y。试推断n、a、y三者的关系表达式。
(2)将下表已知数据代入表达式中进行计算,把计算结果填入表2中有关空格中:
表2
n |
a |
y |
1 |
0.25 |
|
2 |
0.45 |
|
3 |
|
19.35% |
(3)根据上表数据,判断用CO和H2合成甲醇时,H2和CO的最佳体积比是多少?并通过计算说明选择的依据。
[答案]
- 返回 -
|







