化学反应与能量转化
【学习目标】
1.通过了解化学反应中能量变化的实质,学会从微观的角度认识化学反应。
2.通过生产生活中的实例,了解化学能与热能的相互转化。
3.了解原电池的工作原理。
4.能写出电极反应式和电池反应方程式。
5.学会设计简单原电池装置。
【学习重难点】
重点:学会从微观的角度认识化学反应;了解原电池的工作原理。
难点:了解化学能与热能的相互转化;能写出电极反应式和电池反应方程式。
【学习过程】
第一课时
【自主预习】
1.在化学反应过程中,破坏旧化学键,需要____________一定的能量来克服原子(离子)间的相互作用;形成新化学键时,又要____________一定的能量。因此,在化学反应中,不仅有________________________,而且还伴随着________________________。
2.思考:你所知道的能量类型有哪几种?
【合作学习 自主探究】
1.从化学键的角度分析,一个化学反应满足什么条件时吸收能量(释放能量)?
2.化学反应中的能量变化通常主要表现为____________。常见放热反应有哪些类型?试举例说明。
3.化学反应中____________(填“一定”或“不一定”,下同)有新物质生成,____________有能量的变化,____________有化学键的变化。释放能量的反应____________不需要外界条件,吸收能量的反应____________需要外界条件。化学反应中生成物“储存”的能量____________比反应物“储存”的能量高。离子键在形成过程中____________有电子的得失,共价键在形成过程中____________发生共用电子对的偏移,共价化合物中____________不含离子键,离子化合物中____________不含共价键。
4.多角度认识化学反应过程
(1)从原子与分子角度:________________________________________________。
(2)从化学键的角度:化学反应是____________________________________。
(3)从能量变化的角度:化学反应总是伴随着____________________________________。
【典题解悟】
例1.下列说法中正确的是( )
A.物质发生化学反应都伴随着能量变化
B.伴有能量变化的物质变化都是化学变化
C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
D.一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
答案:AC
分析:物质发生化学反应都伴随着能量的变化,伴有能量变化的物质变化不一定是化学变化,物质发生物理变化、核变化(如原子弹的爆炸)也都伴有能量变化。在一个确定的化学反应关系中,反应物的总能量(设为x)与生成物的总能量(设为y)之间的关系为:①x>y,化学反应为放热反应;②x<y,化学反应为放热反应;③ x≠y
点评:本题主要考查对化学反应中物质变化和能量变化的理解和使用。
例2.下列反应中属于吸热反应的是( )
① 液态水汽化
②将明矾加热变为白色粉末
③ 浓硫酸稀释
④ 氯酸钾分解制氧气
⑤ 生石灰跟水反应生成熟石灰
A.①④
B.②③
C.①④⑤
D.②④
答案:D
分析:放热反应⑤ ,吸热反应②④ ,液态水汽化是物理过程;浓硫酸稀释是物理过程。
点评:放热反应和吸热反应都必须是化学反应。
【精练反馈】
1.对于ⅣA族元素,下列叙述中不正确的是( )
A.SiO2和CO2中Si和O,C和O之间都是共价键
B.C、Si、Ge的最外层电子数都是4,次外层电子数都是8
C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应
D.该族元素的主要化合价是-4和+2
![]() 2.已知反应2H H2可放出437.6 kJ的热量,下列说法正确的是( )
2.已知反应2H H2可放出437.6 kJ的热量,下列说法正确的是( )
A.氢分子内每个氢原子都达到了8电子稳定结构
B.氢分子能量比氢原子能量低
C.1 mol氢气理解成2 mol氢原子要放出437.6 kJ的热量
D.氢原子还原性比氢分子弱
3.下列说法不正确的是( )
A.任何化学反应都伴随能量变化
B.化学反应中的能量变化都表现为热量的变化
C.反应物的总能量高于生成物的总能量,则反应释放出能量
D.若化学键形成时释放的能量小于破坏旧化学键所需要吸收的能量,则反应吸收能量
![]() 4.天然气(CH4),液化石油气(C3H8)燃烧的化学方程式为CH4+2O2 CO2+2H2O
4.天然气(CH4),液化石油气(C3H8)燃烧的化学方程式为CH4+2O2 CO2+2H2O
C3H8+5O2=3CO2+4H2O,现在有一套以天然气为燃料的灶具,欲改为燃烧液化石油气,应采取的正确措施是( )
A.减少空气进入量,增大石油气进入量
B.增大空气进入量,减少石油气进入量
C.增大空气进入量,也增大石油气进入量
D.增大空气进入量,或减少石油气进入量
5.下列结构中有离子键的是( )
A.干冰
B.NH4Cl
C.Na2O2
D.HI
6.下列说法正确的是( )
A.两个非金属原子之间不可能形成离子键
B.非金属原子之间不可能形成离子键
C.离子化合物中可能有共价键
D.共价化合物中可能有离子键
7.下列物质中,既含有离子键,又含有共价键的是( )
A.H2O
B.CaCl2
C.NaOH
D.Cl2
8.下列性质中,可以证明某化合物内一定存在离子键的是( )
A.可溶于水
B.具有较高的熔点
C.水溶液能导电
D.熔融状态能导电
9.下列电子式书写正确的是( )
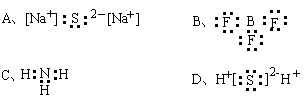
10.(2007重庆)已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 molO=O键完全断裂时吸收热量496 kJ,水蒸气中1 molH—O键形成时放出热量463 kJ,则氢气中1 molH—H键断裂时吸收热量为( )
A.920 kJ
B.557 kJ
C.436 kJ
D.188 kJ
11.(2006上海)下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水
12.已知25 ℃、10l kPa条件下:
![]()
由此得出的正确结论是( )
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量低,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
13.下列反应属于吸热反应的是( )
A.Ba(OH)2与HCl的中和反应
B.葡萄糖在人体内氧化分解
C.Ba(OH)2·8H20与NH4Cl反应
D.锌粒与稀H2S04反应制取H2
14.化学键的断裂和形成的观点不能用于解释下列化学事实中的( )
A.氧化还原反应
B.化学反应的能量变化
C.加成反应
D.化学反应过程的本质
15.下列叙述正确的是( )
A.物质燃烧不一定是放热反应
B.放热反应不需要从外界吸收任何能量就能发生
C.在一个确定的化学反应中,反应物总能量总是高于生成物总能量
D.化学反应除了生成新的物质外,还伴随着能量的变化
16.下列物质中:N2、H2O、Na2O2、CaCl2、KOH、NaF,只含有共价键的物质是_______;只含有离子键的物质是_______;既含有离子键又含有共价键的物质是_______。
17.在H、Na、O、Cl四种元素中,由两种元素组成的离子化合物有_______、_______、_______、_______;由两种元素组成的共价化合物有_______、_______、_______。
18.有下列物质:①金属铜 ②NaOH ③I2 ④MgCl2 ⑤Na2O2 ⑥氩气 回答下列问题:
(1)不存在化学键的是____________________________
(2)存在金属键的是____________________________
(3)只存在非极性键的是____________________________
(4)只存在离子键的是____________________________
(5)既存在离子键又存在极性键的是____________________________
(6)既存在离子键又存在非极性键的是____________________________
【参考答案】
1.B
2.B
3.B
4.D
5.BC
6.AC
7.C
8.D
9.B
10.C
11.A
12.A
13.C
14.A
15.D
16-18.略
第二课时
【教材整理】
铜锌原电池实验:
1.实验装置
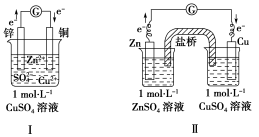
2.实验现象及分析
实验现象 | 检流计指针偏转;锌片溶解,铜片变粗 |
电极反应 | 负极(锌极):Zn-2e-===Zn2+, 氧化反应 正极(铜极):Cu2++2e-===Cu, 还原反应 |
电子流向 | 电子由锌片通过导线流向铜片 |
电池反应 | Zn+Cu2+===Zn2++Cu |
能量转换 | 化学能转化成电能 |
原电池工作原理:
1.原电池
(1)定义:能将化学能转化为电能的装置。
(2)电极名称及电极反应。
①负极:电子流出的一极,发生氧化反应。
②正极:电子流入的一极,发生还原反应。
(3)原电池的构成条件。
①两个活泼性不同的电极(两种金属或一种金属和一种能导电的非金属)。
②电解质溶液。
③构成闭合回路。
④能自发发生的氧化还原反应。
2.工作原理
外电路中电子由负极流向正极;内电路(电解质溶液)中阴离子移向负极,阳离子移向正极;电子发生定向移动从而形成电流,实现了化学能向电能的转化。
1799年,意大利科学家伏特发明了世界上最早的电池——伏特电池。
1836年,英国科学家丹尼尔对“伏特电池”进行了改良,制造了一个能稳定工作的铜锌原电池,称为“丹尼尔电池”。其基本构造如图所示。
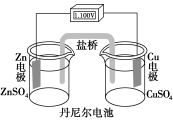
问题思考:
(1)该装置中电子移动方向如何?溶液中的SO4通过盐桥移向锌极吗?
【提示】该原电池中负极是锌,正极是铜,电子由锌极流向铜极,盐桥中的K+向正极移动,Cl-向负极移动,从而平衡电荷,溶液中的SO4不会通过盐桥移向锌极。
(2)取出盐桥,检流计指针还会偏转吗?
【提示】取出盐桥,不能构成闭合回路,检流计指针不会偏转。
(3)将盐桥改为铜导线连接两种溶液,检流计指针还能偏转吗?
【提示】将盐桥改为铜导线连接两种溶液,不能构成原电池,检流计指针不发生偏转。
(4)根据以上现象分析,盐桥起了什么作用?
【提示】盐桥起到了使整个装置构成闭合回路的作用,同时能阻止反应物的直接接触。盐桥中Cl-向ZnSO4溶液迁移,K+向CuSO4溶液迁移,分别中和过剩的电荷,使溶液保持电中性,反应可以继续进行。
原电池中的几个判断:
1.原电池正负极的判断依据
(1)依据电极材料的活泼性判断
负极:活泼性相对强的一极;
正极:活泼性相对弱的一极。
(2)依据电子流向或电流流向判断
负极:电子流出或电流流入的一极;
正极:电子流入或电流流出的一极。
(3)依据溶液中离子移动的方向判断
负极:阴离子移向的一极;
正极:阳离子移向的一极。
(4)依据两极的反应类型判断
负极:发生氧化反应的一极;
正极:发生还原反应的一极。
(5)依据电极反应的现象判断
负极:溶解或减轻的一极;
正极:增重或生成气体的一极。
【特别提醒】正极的作用是导体及产生电势差,它不参与化学反应。负极反应不一定是负极材料本身的反应,有的原电池的负极既是导体又是负极反应物,有的原电池负极的作用是导体,它不参与反应。
原电池原理的应用:
1.加快氧化还原反应的速率
①实验室用粗锌和稀盐酸或稀硫酸反应制H2,加快反应速率;
②如果用纯锌和稀盐酸或稀硫酸反应制H2,可加入少量的CuSO4溶液加快反应速率。
2.比较金属的活动性强弱
原电池中,负极的金属活动性>正极的金属活动性。
3.设计原电池
①将已知氧化还原反应拆分为两个半反应;
②根据原电池的电极反应特点,结合两个半反应找出正负极材料及电解质溶液。
【精练反馈】
题组1原电池原理
1.如图所示的装置能构成原电池产生电流的是( )
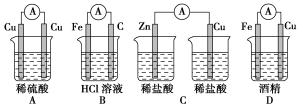
【解析】A项中的电极相同;C项中未构成闭合回路;D项中酒精是非电解质。
【答案】B
2.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
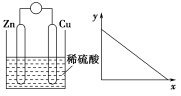
图1 图2
A.铜棒的质量
B.c(Zn2+)
C.c(H+)
D.c(SO4)
【解析】该装置构成原电池,Zn是负极,Cu是正极。A.在正极Cu上溶液中的H+获得电子变为氢气,Cu棒的质量不变,错误;B.由于Zn是负极,不断发生反应Zn-2e-===Zn2+,所以溶液中c(Zn2+)增大,错误;C.由于反应不断消耗H+,所以溶液的c(H+)逐渐降低,正确;D.SO4不参加反应,其浓度不变,错误。
【答案】C
3.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
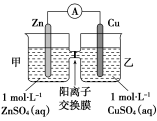
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO4)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
【解析】A.Cu作正极,电极上发生还原反应,错误;B.电池工作过程中,SO4不参加电极反应,故甲池的c(SO4)基本不变;C.电池工作时,甲池反应为Zn-2e-===Zn2+,乙池反应为Cu2++2e-===Cu,甲池中Zn2+会通过阳离子交换膜进入乙池,以维持溶液中电荷平衡,由电极反应式可知,乙池中每有64 g Cu析出,则进入乙池的Zn2+为65 g,溶液总质量略有增加,正确;D.由题干信息可知,阴离子不能通过阳离子交换膜。
【答案】C
题组2正负极判断
4.原电池的正极一定是( )
A.化学性质较活泼的金属
B.化学性质较不活泼的金属
C.电子流出的一极
D.电子流入的一极
【解析】正极的判断方法:(1)外电路电流流出,电子流入的一极;(2)发生还原反应;(3)化学性质较不活泼的金属或惰性电极;(4)阳离子移向的一极;(5)常见有气泡冒出或有金属析出的电极。
【答案】D
5.在如图所示的水果电池中,外电路上的电流从X电极流向Y电极。若X为铁,则Y可能是( )
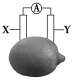
A.锌 B.石墨 C.银 D.铜
【解析】电流的方向与电子的移动方向相反,由已知条件知电子由Y电极流向X电极,因此Y电极的金属活动性强于铁,故Y电极只能为选项中的锌。
【答案】A
6.某原电池,将两金属X、Y用导线连接,同时插入相应的电解质溶液中,发现Y电极质量增加,则可能是下列情况中的( )
A.X是负极,电解质溶液为CuSO4溶液
B.X是负极,电解质溶液为稀H2SO4溶液
C.X是正极,电解质溶液为CuSO4溶液
D.X是正极,电解质溶液为稀H2SO4溶液
【解析】Y电极质量增加,说明溶液中的阳离子得电子而在Y极(正极)上析出金属形成的。
【答案】A
题组3原电池原理的应用
7.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,外电路电流由d到c;a、c相连时,c上产生大量气泡;b、d相连时,b上有大量气泡产生,则四种金属的活动性由强到弱的顺序为( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
【解析】在金属与稀硫酸组成的原电池中活泼金属作负极。所以有a>b,c>d,a>c,d>b。
【答案】B
8.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
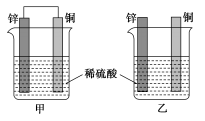
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
【解析】由题目所给图示可知,甲为原电池,铜作正极,发生反应:2H++2e-===H2↑,反应速率加快;乙不能构成原电池(无闭合回路),只在锌片上发生反应:Zn+2H+===Zn2++H2↑,二者都消耗H+,故溶液的pH都增大。
【答案】C
9.依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示。
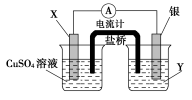
请回答下列问题:
(1)电极X的材料是______;电解质溶液Y是______。
(2)银电极为电池的________极,发生的电极反应为_____________;X电极上发生的电极反应为_______________________________________________。
(3)外电路中的电子是从________电极流向________电极。
【解析】由题给反应可知以下信息
电极 | 材料 | 电极反应 |
负极 | Cu | Cu-2e-===Cu2+ |
正极 | Ag | Ag++e-===Ag |
则X为Cu,Y为AgNO3溶液。
【答案】(1)铜 AgNO3溶液
(2)正 Ag++e-===Ag Cu-2e-===Cu2+
(3)铜 银