从化石燃料中获取有机化合物
从化石燃料中获取有机化合物
第1课时
【学习目标】
1.了解石油的化学成分及石油分馏、裂化和裂解的基本原理.
2.掌握乙烯的分子结构、主要性质和重要应用,进一步理解结构与性质的关系.
3.了解加成反应,会书写乙烯与H2、HCl、Cl2、H2O发生加成反应的化学方程式.
【学习重难点】
重点:掌握乙烯的分子结构、主要性质和重要应用,进一步理解结构与性质的关系.
难点:了解加成反应,会书写乙烯与H2、HCl、Cl2、H2O发生加成反应的化学方程式.
【学习过程】
【新知导学】
一、石油的炼制
1.石油的组成
石油主要是由分子中含有不同数目碳原子的烃组成的复杂混合物,主要包括各种烷烃、环烷烃和芳香烃.石油中所含元素主要有碳和氢两种元素.
2.石油的分馏
(1)石油是以含多种烃为主的混合物,没有固定的沸点.加热石油,沸点低的烃(含碳原子数较少的)先汽化,其蒸气经冷凝变为液体首先从混合物里分离出来;随着温度的升高,沸点较高的烃(含碳原子数较多的)再汽化,经过冷凝也从混合物里分离出来.通过不断地加热和冷凝,把石油分成不同沸点范围的产物,这种方法称为石油的分馏.
(2)石油经过分馏后得到的一系列产物有石油气、汽油、煤油、柴油、重油及沥清等.
(3)分馏石油得到的各种馏分仍是混合物.
3.石油的裂化
(1)石油裂化的原理:在一定条件(加热、使用催化剂)下,使相对分子质量大、沸点高的烃断裂成相对分子质量较小、沸点较低的烃.如:十六烷的裂化反应:
C16H34催化剂C8H16+C8H18.
(2)石油裂化的目的:提高汽油等轻质液体燃料的产量和质量.
4.石油的裂解
(1)石油裂解的原理:裂解是采用比裂化更高的温度,使相对分子质量较大的烃断裂成乙烯、丙烯等小分子烃.裂化和裂解都是化学变化.石油裂解气里乙烯的含量比较高.
(2)石油裂解的目的:是为了获得乙烯、丙烯等小分子烯烃,做为有机化工原料.
【归纳总结】
1.石油炼制方法比较
炼制方法 | 分馏 | 裂化 | 裂解 |
主要变化类型 | 物理变化 | 化学变化 | 化学变化 |
主要原料 | 原油 | 重油 | 石油分馏产品 (包括石油气) |
目的 | 将石油分离成不同沸点范围的产物 | 提高轻质液体燃料的产量和质量 | 得到气态短链烃 |
主要产品 | 石油气、汽油、煤油、柴油及重油等 | 汽油等轻质燃油 | 乙烯、丙稀等小分子烃 |
2.直馏汽油和裂化汽油的区别
获得方法 | 主要化学成分 | |
直馏汽油 | 原油分馏 | 一般是C5~C11的烷烃及少量的芳香烃等 |
裂化汽油 | 重油裂化 | 含有C5~C11的烷烃和烯烃 |
3.裂化和裂解都是使石油分馏产物中的长链烃断裂生成更短的链烃,裂解所需温度比裂化所需的温度更高,裂化和裂解的原料、目的和产品不同.
【活学活用】
1.下列关于石油加工的叙述中,不正确的是( )
A.石油分馏所得的产物是具有恒定沸点的纯净物
B.石油裂化的目的是提高汽油等轻质燃油的产量和质量
C.石油裂解的原料是石油分馏产物,包括石油气
D.石油的分馏是物理变化过程
答案:A
解析:石油分馏得到的馏分是不同沸点范围的产物,仍为混合物,A项错误,B、C两项正确;在石油常见的炼制方法中,分馏是物理变化,而裂化和裂解是化学变化,D项正确.
规律总结:石油分馏产物、裂解及裂化产物均是混合物,没有固定熔、沸点.裂化汽油和分馏汽油的成分不同.
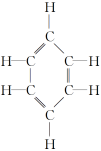
二、乙烯的分子结构
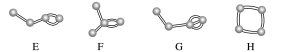
1.下图表示4个碳原子相互结合的几种方式.小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合.
![]()
(1)它们同属于有机物中的____________类,其中烷烃有____________(填字母).
(2)在结构上B与A的主要不同是__________________________________________
______________;B应属于烃的类别是________________.
(3)分子中碳原子所结合的氢原子数少于饱和烃里的氢原子数的碳氢化合物称为____________.分子中含有______________的烃称为烯烃.若烯烃含有一个碳碳双键,该类烯烃的组成通式为________________.
(4)写出上图中烯烃的结构简式,并简述你是怎样从上图中识别烷烃和烯烃的.
答案:(1)烃 AC
(2)B中有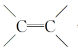 键,比A少两个H原子 不饱和烃(或烯烃)
键,比A少两个H原子 不饱和烃(或烯烃)
(3)不饱和烃 碳碳双键 CnH2n(n≥2)
(4)B:CH3CH===CHCH3 E:CH3CH2CH===CH2
F:(CH3)2C===CH2,识别烷烃和烯烃要看分子结构中有无碳碳双键:若碳原子之间全部以碳碳单键结合的链烃,就是烷烃;若分子中含有碳碳双键的链烃,则为烯烃.
2.以下是两种有机物的球棍模型,![]() 代表H原子,
代表H原子,![]() 代表C原子,请回答下列问题:
代表C原子,请回答下列问题:
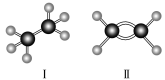
(1)Ⅰ、Ⅱ的分子式分别为________、________.
(2)说出Ⅰ、Ⅱ结构上的两点差异①_________________________________________;
②________________________________________________________________________.
答案:(1)C2H6 C2H4
(2)①Ⅰ中含有碳碳单键,Ⅱ中含有碳碳双键 ②Ⅰ是空间立体结构,Ⅱ是平面结构
解析:从球棍模型上可以得知:Ⅰ为乙烷,Ⅱ为乙烯.乙烷中有碳碳单键,乙烯中有碳碳双键,且前者是空间立体结构,后者是平面结构.
【归纳总结】
乙烯的分子组成与结构
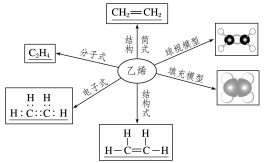
空间结构:所有C、H原子都在同一平面上.
关键提醒:碳碳双键决定乙烯的化学性质.
【活学活用】
2.关于乙烯分子结构的描述正确的是( )
A.乙烯的分子式为、结构简式、最简式分别为(CH2)2、CH2CH2、CH—CH
B.乙烯不是最简单的烯烃
C.乙烯分子中所有原子都在同一平面上
D.乙烯分子中所有原子都在一条直线上
答案:C
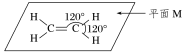
解析:乙烯的分子式为C2H4,最简式为CH2,结构简式为CH2===CH2,乙烯分子中所有原子都在一个平面上,不在同一条直线上.烯烃是指含有碳碳双键的烃,乙烯是最简单的烯烃.
易错警示:由乙烯分子结构可以推断有机物![]() 分子中的所有碳原子共面.
分子中的所有碳原子共面.
三、乙烯的化学性质
1.乙烯的氧化反应
(1)观察实验,记录现象.
实验 | 现象 |
点燃乙烯 | 火焰明亮,伴有黑烟,同时放出大量热 |
将乙烯通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液退色 |
(2)写出乙烯燃烧的化学方程式.为什么甲烷燃烧没有黑烟,而乙烯燃烧有较浓的黑烟?
答案:C2H4+3O2点燃2CO2+2H2O,乙烯分子里含碳量比较大,未完全燃烧,产生碳的小颗粒造成的.
(3)乙烯可以作水果的催熟剂,可以使生果实尽快成熟,但是用浸泡过酸性高锰酸钾溶液的硅藻土与果实或花朵放在一起,可以延长果实或花朵的成熟期,达到保鲜的目的.请你解释其中的奥秘.
答案:乙烯能被酸性高锰酸钾溶液氧化.
2.乙烯的加成反应
(1)加成反应:有机物分子中双键上的碳原子与其他原子(或原子团)直接结合生成新的化合物分子的反应叫加成反应.如将乙烯通入溴的四氯化碳溶液中,现象是橙红色退去,生成了1,2二溴乙烷.
(2)请你设计实验验证乙烯通入溴水发生的不是取代反应.写出该加成反应的化学方程式.
答案:比较通入乙烯前后溴水的酸性强弱,通入乙烯之后溴水的酸性减弱,说明发生的不是取代反应.
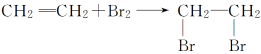
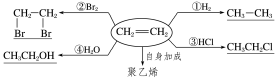
(3)乙烯除了与溴加成外,一定条件下还能与H2、HCl、Cl2、H2O等发生加成反应,请你写出相关反应的化学方程式.
答案:CH2===CH2+H2催化剂CH3—CH3
CH2===CH2+HCl催化剂CH3CH2Cl
CH2===CH2+Cl2―→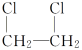
CH2===CH2+H2O一定条件CH3CH2OH
(4)聚乙烯(CH2—CH2)在日常生活中用途很广,是一种高分子化合物,如用做食品保鲜膜、水管材料等.它是由乙烯分子在一定条件下相互加成得到的,写出合成聚乙烯的化学方程式.
答案:nCH2===CH2一定条件CH2—CH2
3.如何区分甲烷和乙烯?甲烷中混有乙烯时如何除去?
答案:乙烯能使酸性KMnO4溶液或溴水退色,由此可区别甲烷(烷烃)和乙烯(烯烃).乙烯被酸性KMnO4溶液氧化的产物是CO2,因此CH4中混有乙烯时,不能用酸性高锰酸钾溶液除去(引入新的杂质),应用溴水洗气除去,并用浓硫酸干燥,或用Br2的CCl4溶液洗气除去.
【归纳总结】
1.乙烯的氧化反应
(1)乙烯能燃烧,火焰明亮且伴有黑烟.
①利用燃烧时的现象与甲烷不同,可用燃烧法鉴别甲烷和乙烯.
②为防止乙烯与空气混合点燃发生爆炸,点燃乙烯之前,一定要检验其纯度.
③若乙烯燃烧温度高于100 ℃,H2O为气态,则反应前后气体体积不变;完全燃烧后产生的CO2和H2O的物质的量之比为1∶1.
(2)被酸性高锰酸钾溶液氧化
①乙烯使酸性高锰酸钾溶液退色.利用该性质可鉴别甲烷(或烷烃)和乙烯(或烯烃).
②酸性高锰酸钾溶液将乙烯最终氧化为CO2,所以除去甲烷中的乙烯时不能用酸性高锰酸钾溶液.
2.乙烯的加成反应
关键提醒:(1)结构决定性质,乙烯的化学性质(能被酸性高锰酸钾溶液氧化、发生加成反应)是由碳碳双键所决定的.
(2)乙烯使溴水、酸性KMnO4溶液退色原理不同,前者为加成反应,后者为氧化反应.
(3)加成反应是乙烯等不饱和烃的特征性质;烷烃的特征性质是取代反应.
【活学活用】
3.甲烷中混有乙烯,欲除去乙烯得到纯净干燥的甲烷,可依次将其通过下列哪组试剂的洗气瓶( )
A.澄清石灰水,浓H2SO4
B.溴水,浓H2SO4
C.酸性高锰酸钾溶液,浓H2SO4
D.浓H2SO4,酸性高锰酸钾溶液
答案:B
解析:A项,乙烯和甲烷均不与澄清石灰水及浓硫酸反应;B项,乙烯与Br2加成生成液体1,2二溴乙烷,再用浓硫酸干燥得到干燥纯净的CH4;C项,酸性KMnO4溶液与乙烯反应生成CO2,引入新杂质;D项,浓H2SO4与乙烯不反应.
规律总结:除去乙烷中的乙烯并得到纯净干燥的乙烷,操作方法如下:
(1)混合气体→盛有溴水的洗气瓶→盛有NaOH溶液的洗气瓶→盛有浓硫酸的洗气瓶;
(2)混合气体→盛有溴水的洗气瓶→装有碱石灰的U形管;
(3)混合气体→盛有酸性KMnO4溶液的洗气瓶→盛有NaOH溶液的洗气瓶→盛有浓硫酸的洗气瓶;
(4)混合气体→盛有酸性KMnO4溶液的洗气瓶→装有碱石灰的干燥管.
4.体育比赛中当运动员肌肉挫伤或扭伤时,队医随即对准运动员的受伤部位喷射药剂氯乙烷(CH3—CH2Cl)(沸点为12.27 ℃),进行局部冷冻麻醉应急处理.制取氯乙烷的最好方法是( )
A.乙烷与氯气发生取代反应
B.乙烯与氯气发生加成反应
C.乙烷与氯化氢混合
D.乙烯与氯化氢发生加成反应
答案:D
解析:乙烷与Cl2发生取代反应生成多种氯代烃的混合物;乙烯与Cl2发生加成反应生成1,2二氯乙烷;乙烷与氯化氢不反应;乙烯与氯化氢发生加成反应生成氯乙烷.D项正确.
规律总结:甲烷取代反应与乙烯加成反应的比较
取代反应 | 加成反应 | |
反应物特征 | 含有易被取代的原子或原子团 | 不饱和有机化合物(含 |
生成物 | 两种(一般是一种有机化合物和一种无机物) | 一种(有机化合物) |
碳碳键变化 | 无变化 |
|
反应特点 | 一上一下 | 断一加二 |
常用试剂 | Cl2、Br2、I2 | H2、X2、HX、H2O (X为Cl、Br、I) |
【学习小结】
乙烯的性质
稍有气味水难溶,高锰酸钾溴反应.
现象相同理不同,前因氧化后加成.
加氧燃烧黑烟冒,聚合分子碳链增.
 第2课时
第2课时
【学习目标】
1.了解煤的干馏及其产品的应用.
2.会书写苯的分子式、结构式、结构简式,知道苯分子中的碳碳键是一种介于碳碳单键与碳碳双键之间的独特的键.
3.知道苯能够发生氧化反应、加成反应、取代反应,并会写相应的化学方程式.
【学习重难点】
重点:会书写苯的分子式、结构式、结构简式.
难点:知道苯能够发生氧化反应、加成反应、取代反应,并会写相应的化学方程式.
【学习过程】
【新知导学】
一、煤的干馏
1.煤的组成
煤是由有机化合物和无机化合物组成的复杂的混合物,除了含有碳、氢元素外,还含有少量的氮、硫、氧等元素;混合物里的无机化合物主要含硅、铝、钙、铁等元素.
2.煤的干馏
(1)煤的干馏是将煤隔绝空气加强热使其分解的过程.
(2)煤干馏的产物:煤通过干馏后,得到焦炉气、煤焦油、粗氨水、粗苯和焦炭等.这些产品的主要用途如下表所示:
干馏产物 | 主要成分 | 主要用途 | |
炉煤气 | 焦炉气 | 氢气、甲烷、乙烯、一氧化碳 | 气体燃料、化工原料 |
粗氨水 | 氨气、铵盐 | 氮肥 | |
粗苯 | 苯、甲苯、二甲苯 | 炸药、染料、医药、农药、合成材料 | |
煤焦油 | 苯、甲苯、二甲苯 | ||
酚类、萘 | 医药、染料、农药、合成材料 | ||
焦炭 | 沥青 | 电极、筑路材料 | |
碳 | 冶金、燃料、合成氨 | ||
【归纳总结】
1.煤的干馏过程中主要发生化学变化.
2.煤的干馏条件:一要隔绝空气,二是要加强热.
【活学活用】
1.下列关于煤的干馏的叙述中,正确的是( )
A.煤加强热而分解的过程叫做煤的干馏
B.煤中含有苯、甲苯、二甲苯等有机化合物
C.煤的干馏是化学变化,石油的分馏是物理变化
D.苯、甲苯、二甲苯等可由煤干馏得到,存在于干馏所得的焦炉气中
答案:C
解析:A项,干馏需要隔绝空气加强热,错误;B项,煤本身不含苯、甲苯、二甲苯等有机物,这些有机物是煤的干馏产物,错误;C项,煤的干馏是化学变化,石油的分馏是物理变化,正确;D项,苯、甲苯等芳香烃主要存在于粗苯和煤焦油中,错误.
易错警示 煤本身不含苯、甲苯、二甲苯、萘、蒽等有机物,这些有机物是煤的干馏产物.
2.下列关于煤的说法正确的是( )
A.煤中含有碳,可看作是无机化合物
B.采用原煤脱硫技术,能减少污染
C.煤的干馏产物都是有机物
D.焦炭是煤干馏的一种重要产品,煤焦油是煤干馏所得的纯净物
答案:B
解析:煤是由无机化合物和有机化合物组成的复杂的混合物;采用煤脱硫技术,能减少二氧化硫的排放;煤的干馏产物也有无机物,如氨气、氢气等;焦炭和煤焦油都是煤干馏的产物,煤焦油是混合物.
拓展延伸:煤的加工方法还有煤的气化和液化.煤的气化就是C+H2O高温CO+H2的过程;煤的液化就是使煤转化为液体燃料(液态碳氢化合物和含氧有机化合物)的过程.二者均发生化学变化.
二、苯的分子结构
1.苯是一种重要的化工原料,其分子式为C6H6,远没有达到饱和.根据下列实验,总结苯的某些性质.
实验内容 | 实验现象 | 实验结论 |
向试管中加入3 mL酸性高锰酸钾溶液,再加入1 mL苯,振荡试管,观察现象 | 液体分为两层,上层无色,下层紫红色 | 苯不能被酸性高锰酸钾溶液氧化 |
向试管中加入1 mL溴水,再加入3 mL苯,振荡试管,观察现象 | 液体分为两层,上层橙红色,下层无色 | 苯不能与溴水发生反应 |
2.德国化学家凯库勒在苯分子结构的确定中做出了重要贡献,他分析了大量实验事实之后,提出了苯的分子结构为![]() ,我们称其为凯库勒式并一直沿用到现在.
,我们称其为凯库勒式并一直沿用到现在.
(1)你认为这种结构符合实验事实吗?说出你的理由.
答案 不符合实验事实,因为苯不能与溴水发生加成反应而使溴水退色,也不能被酸性KMnO4溶液氧化,说明它没有典型的碳碳双键.
(2)查阅资料,苯分子结构的另一种表达方式为![]() ,用文字归纳苯分子的空间结构和化学键的特征.
,用文字归纳苯分子的空间结构和化学键的特征.
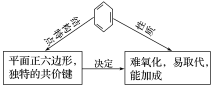
答案:苯分子为平面正六边形结构,6个碳碳键完全相同,是介于碳碳单键和碳碳双键之间的独特的化学键.
![]() 归纳总结
归纳总结![]()
苯的组成与结构
分子模型 | 分子式 | 结构式 | 结构简式 |
| C6H6 |
|
|
关键提醒:苯分子中不存在碳碳单键,也不存在碳碳双键,而是一种介于碳碳单键和碳碳双键之间的独特的键.
【活学活用】
3.能说明苯分子的平面正六边形结构中,碳碳键不是单、双键交替排布,而是6个碳原子之间的键完全相同的事实是( )
A.苯的一氯取代物(![]() )无同分异构体
)无同分异构体
B.苯的邻位二氯取代物(![]() )只有1种
)只有1种
C.苯的间位二氯取代物(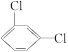 )只有1种
)只有1种
D.苯的对位二氯取代物(![]() )只有1种
)只有1种
答案:B
解析:苯分子结构中无论是单、双键交替出现,还是6个碳原子之间的键完全相同,苯的一取代物都只有一种结构,间位二取代物、对位二取代物也都只有一种结构,因此A、C、D项不能用以说明苯环不存在单、双键交替结构;B项,苯分子结构中若单、双键交替出现,则苯的邻位二取代物有两种结构,因此B项可以说明苯分子不存在单、双键交替结构.
规律总结:以下事实均可以证明苯中没有单、双键的结构
(1)苯不能使酸性KMnO4溶液退色;
(2)苯不能使溴的四氯化碳溶液退色,苯与溴水不反应;
(3)苯分子为平面正六边形,苯分子中碳碳键长完全相等;
(4)邻二甲苯(![]() )只有一种结构.
)只有一种结构.
4.下列物质的所有原子,不可能处于同一平面上的是( )
A.CH3CH===CH2
B.CH2===CH2
C.![]()
D.![]()
答案:A
解析:乙烯和苯都属于平面形结构,所有原子都处于同一平面内,而甲烷分子是正四面体结构,故可以得出甲基中的原子不可能处于同一平面内,A项含有甲基,所有原子不可能共面,C项可以看作是乙烯中的一个氢原子被苯环取代,推知C项中物质的所有原子可能处于同一平面内.
规律总结:甲烷、苯、乙烯分子中的H原子如果被其他原子(如C、O、N、Cl等)所取代,则取代后的分子构型基本不变;当分子中碳原子与其他原子形成四个单键时,所有原子不可能共面;共价单键可以自由旋转,共价双键不能旋转.
三、苯的性质
1.纯净的苯是无色、有特殊气味的液体,密度比水小,难溶于水,有毒.苯是一种重要溶剂,沸点80.5 ℃,易挥发,熔点5.5 ℃,若用冰冷却,可凝结成无色晶体.居室中的苯主要来自于新漆家具和装饰材料.由油漆挥发出来的苯通过皮肤接触或呼吸进入人体后影响人的造血系统,引起白细胞减少.
2.苯不能被酸性KMnO4溶液氧化,但能燃烧.苯燃烧时,发出明亮而且带有浓烟的火焰,这是由于苯分子含碳量高,碳燃烧不充分.其燃烧的化学方程式为2C6H6+15O2点燃12CO2+6H2O.
3.苯与浓硝酸和浓硫酸的混合物共热至55~60 ℃,发生反应,苯环上的氢原子被硝基(—NO2)取代,生成硝基苯,反应的化学方程式是
![]() .
.
(1)反应中要用浓硫酸做催化剂和吸水剂,如何混合浓硫酸和浓硝酸?
答案:将浓H2SO4沿试管内壁慢慢注入浓硝酸中,并不断振荡.
(2)怎样控制反应温度为55~60 ℃?
答案:在55~60 ℃的水中进行水浴加热.
4.在有催化剂FeBr3存在时,苯与液溴发生反应,苯环上的氢原子被溴原子取代,生成溴苯,反应的化学方程式是
![]() .
.
5.苯虽然不具有像烯烃一样典型的碳碳双键,但在特定条件下,仍能发生加成反应,在镍做催化剂的条件下,苯可以与氢气发生加成反应,化学方程式是 ![]() .
.
【归纳总结】
1.苯的化学性质
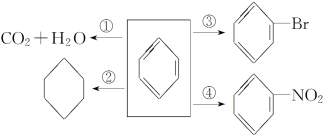
反应类型:①氧化反应;②加成反应;③取代反应;④取代反应.
2.苯在催化剂(FeBr3)作用下与液溴发生取代反应,说明苯具有类似烷烃的性质;苯能与H2在催化剂作用下发生加成反应,说明苯具有类似烯烃的性质.苯易发生取代反应,能发生加成反应,难被氧化(燃烧除外),其化学性质不同于烷烃和烯烃.
3.甲苯(![]() )在光照下能与卤素单质发生取代反应,取代—CH3上的氢原子;在催化剂FeBr3作用下能与液溴发生取代反应,取代的是苯环上的氢原子.
)在光照下能与卤素单质发生取代反应,取代—CH3上的氢原子;在催化剂FeBr3作用下能与液溴发生取代反应,取代的是苯环上的氢原子.
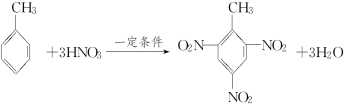
4.甲苯比苯易与HNO3发生取代反应
【活学活用】
5.下列反应中前者属于取代反应,后者属于加成反应的是( )
A.甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液退色
B.乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷
C.苯与浓硝酸和浓硫酸的混合液反应生成油状液体;乙烯与水生成乙醇的反应
D.在苯中滴入溴水,溴水退色;乙烯与溴水反应
答案:C
解析:甲烷与Cl2在光照下的反应是取代反应,乙烯使酸性KMnO4溶液退色发生的是氧化反应,A错;乙烯与溴的四氯化碳溶液发生加成反应,生成CH2Br—CH2Br,苯与H2在一定条件下发生加成反应生成![]() (环己烷),B错;苯与浓硫酸、浓硝酸的混合物的反应是硝化反应,属于取代反应:
(环己烷),B错;苯与浓硫酸、浓硝酸的混合物的反应是硝化反应,属于取代反应:![]() +HNO3浓硫酸
+HNO3浓硫酸![]() +H2O,
+H2O,![]() 为油状液体,乙烯与水在一定条件下生成乙醇:CH2===CH2+H—OH催化剂CH3CH2OH,是加成反应,C对;苯与溴水发生萃取,是物理现象,乙烯与溴水发生加成反应,D错.
为油状液体,乙烯与水在一定条件下生成乙醇:CH2===CH2+H—OH催化剂CH3CH2OH,是加成反应,C对;苯与溴水发生萃取,是物理现象,乙烯与溴水发生加成反应,D错.
规律总结:各类烃与液溴、溴水、溴的四氯化碳溶液、酸性KMnO4溶液反应的比较
物质 | 液溴 | 溴水 | 溴的四氯化碳溶液 | 酸性KMnO4溶液 |
烷烃 | 与溴蒸气在光照条件下发生取代反应 | 不反应,液态烷烃可以萃取溴而使溴水退色 | 不反应,互溶,不退色 | 不反应 |
烯烃 | 发生加成反应 | 加成退色 | 加成退色 | 氧化退色 |
苯 | 一般不反应,在催化剂作用下可发生取代反应 | 不反应,可萃取溴而使溴水退色 | 不反应,互溶,不退色 | 不反应 |
【学习小结】
 第3课时
第3课时
【学习目标】
1.认识有机高分子化合物的结构、性质及其应用.
2.会书写加聚反应的化学方程式.
【学习重难点】
重点:认识有机高分子化合物的结构、性质及其应用.
难点:会书写加聚反应的化学方程式.
【学习过程】
【新知导学】
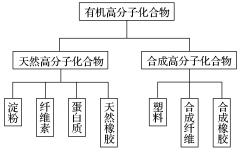
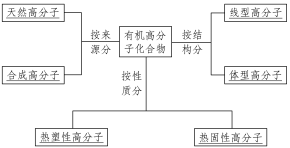
一、有机高分子化合物
1.有机高分子化合物的概念
(1)写出下列有机物的化学式:①乙醇:CH3CH2OH;②葡萄糖:C6H12O6;③纤维素:(C6H10O5)n;④聚乙烯:CH2—CH2.
(2)纤维素、聚乙烯与乙醇、葡萄糖相比较,它们的相对分子质量很大.
(3)由上分析可知,相对分子质量很大的有机物叫有机高分子化合物,简称高分子或聚合物.
2.有机高分子化合物的结构特点
有机高分子化合物通常由简单的结构单元重复连接而成,如CH2—CH2中的结构单元是—CH2—CH2—,n是结构单元重复的次数.由于连接的方式不同,又可分为两种结构——线型(链状)和体型(网状)结构.
(1)线型结构:高分子中的结构单元连接成长链.具有线型结构的高分子,可以带支链,也可以不带支链,如聚乙烯CH2—CH2、聚丙烯![]() 等.
等.
(2)体型结构:高分子链上如果有能起反应的原子或原子团,当这些原子或原子团发生反应时,高分子链之间将形成化学键,产生一定的交联形成网状结构,这就是高分子的体型结构,如酚醛树脂(俗称电木)等.
3.有机高分子化合物的基本性质
(1)按下列要求完成实验,并填表:
实验操作 | 实验现象 | 实验结论 |
| 试管中的粉末胀大 | 体型有机高分子不易溶解,只有一定程度的胀大 |
| 加热先变软,然后熔化,最后燃烧 | 线型高分子化合物具有热塑性 |
(2)由上述实验归纳总结高分子化合物的基本性质:
①溶解性:线型高分子化合物可溶解在适当的溶剂中,但溶解速率较慢,最后形成均匀的高分子溶液;体型高分子化合物不溶于任何溶剂,长期浸泡在溶剂中只能发生一定程度的溶胀.
②热塑性和热固性:线型高分子化合物具有热塑性,在一定温度范围内可软化、熔化,冷却又可硬化.体型高分子化合物具有热固性,加工成型后受热不能熔化.
③强度:有机高分子化合物材料通常都有较大或很大的强度.
④电绝缘性:高分子化合物中的原子是以共价键结合的,一般不导电,是很好的绝缘材料.
【归纳总结】
【活学活用】
1.下列关于高分子化合物的叙述正确的是( )
A.高分子化合物结构复杂,相对分子质量很大
B.高分子化合物结构简单,相对分子质量很大
C.高分子化合物是纯净物
D.高分子化合物性质稳定,都具有可塑性
答案:B
解析:高分子化合物虽然相对分子质量很大,但分子中多是重复的结构单元,结构比较简单.因为重复的结构单元的个数不同,所以其是混合物.线型高分子化合物具有热塑性,体型高分子化合物具有热固性.
易错警示:高分子化合物一般是混合物.
2.现在有两种高聚物A和B,A能溶于氯仿等有机溶剂,并能在加热到一定温度时熔融成黏稠状的液体,B不溶于任何溶剂,加热不会变软或熔融,则下列叙述中不正确的是( )
A.高聚物A可能具有弹性,而高聚物B一定没有弹性
B.高聚物A一定是线型高分子材料
C.高聚物A一定是体型高分子材料
D.高聚物B一定是体型高分子材料
答案:C
解析:由于线型高分子材料具有热塑性,加热时会变软、流动,能溶于适当的有机溶剂中,而体型高分子具有热固性,受热不会变软,只能被彻底裂解,且不溶于有机溶剂,只能有一定程度的溶胀,C项正确.
规律总结:线型高分子化合物与体型高分子化合物的区别
结构特点 | 线型结构 | 体型(网状)结构 | ||
基本 性质 | 溶解性 | 有机溶剂 | 缓慢溶解 | 只溶胀,不溶解 |
水 | 不溶 | 不溶 | ||
性质 | 热塑性 | 热固性 | ||
电绝缘性 | 好 | 好 | ||
可燃性 | 一般易燃烧 | 一般不易燃烧 | ||
二、聚合反应
1.加聚反应:由相对分子质量小的化合物生成相对分子质量很大的有机高分子化合物的反应叫聚合反应.由不饱和的小分子相互加成的聚合反应,叫加成聚合反应,简称加聚反应.例如,乙烯可发生加聚反应生成聚乙烯.反应方程式为nCH2===CH2引发剂CH2—CH2.
2.聚合反应中的单体、链节和聚合度:
单体 | 链节 | 聚合度 | |
定义 | 能合成高分子化合物的小分子物质 | 高分子化合物中的重复结构单元 | 链节的重复次数 |
实例(聚乙烯) | CH2===CH2 | —CH2—CH2— | n |
3.写出下列物质发生加聚反应的生成物:
(1)氯乙烯的加聚:![]() 引发剂
引发剂![]() ;
;
(2)丙烯的加聚:
nCH2 ===CHCH引发剂![]() ;
;
(3)苯乙烯的加聚:
![]() 引发剂
引发剂 ;
;
(4)四氟乙烯的加聚:nCF2===CF2引发剂CF2—CF2.
【归纳总结】
1.加聚反应的特点
(1)反应物特征——含有不饱和键.
(2)产物特征——高分子化合物与反应物具有相同的组成.
(3)反应特征——没有小分子化合物生成.
2.加聚反应方程式的书写
(1)在加聚反应中,不饱和的碳原子作为端点相互连接成长链,而饱和的碳原子作为支链.
(2)含双键的化合物发生的加聚反应类似于乙烯的加聚反应,可理解为乙烯中的氢原子被其他原子或原子团代替后而发生加聚反应.
关键提醒 写高聚物时要注意,原来的主链不一定是结构单元中的主链,如聚丙烯不能写成CH3CHCH2,应该是 .
.
【活学活用】
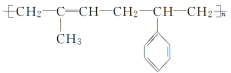
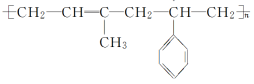
3.异戊二烯( )和苯乙烯(
)和苯乙烯(![]() )按物质的量比为1∶1发生加聚反应,该加聚产物的结构简式不可能为( )
)按物质的量比为1∶1发生加聚反应,该加聚产物的结构简式不可能为( )
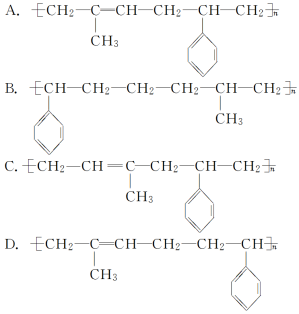
答案:B
解析: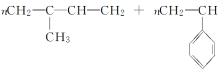
引发剂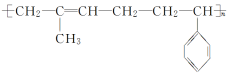 或
或
 或
或
 .
.
规律总结:加聚反应的类型
(1)单烯烃的加聚
规律:断开双键,键分两端,添上括号,n写后面.如丙烯的聚合:nCH3—CH===CH2引发剂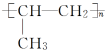 .
.
(2)二烯烃的加聚
规律:单变双,双变单,破两头,移中间,添上括号,n写后面.
如:nCH2===CH—CH===CH2引发剂
CH2—CH===CH—CH2.
(3)几种单体间的共聚
规律:双键打开,中间相连,添上括号,n写后面.
如:nCH2===CH2+nCH2===CH—CH3引发剂
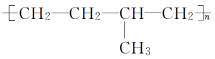
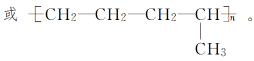
4.丁苯橡胶的结构简式为
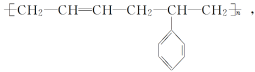
写出形成丁苯橡胶的各单体的结构简式:_________________________________、
________________、____________________(可不填满,也可补充).
答案:CH2===CH—CH===CH2 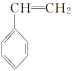
解析:方法一:从结构单元的一端开始,利用弯箭头将键转移——箭尾处去掉一键,箭头处形成一键,可得单体.
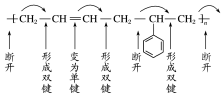
方法二:二四分段法:选定聚合物的结构单元,从一侧开始分段,如果在结构单元的主链上遇到![]() ,可将4个C分为一段,其余则2个C为一段,从段的连接处断开,形成碳碳双键,可得单体.如:
,可将4个C分为一段,其余则2个C为一段,从段的连接处断开,形成碳碳双键,可得单体.如:
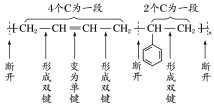
于是得到单体:CH2===CH—CH===CH2、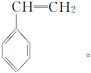
规律总结:加聚反应产物单体的书写与判断
1.链节主链只有两个碳原子(无其他原子)高聚物的单体为一种,将两个半键闭合即可.
如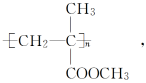 ,其单体是
,其单体是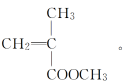
2.链节主链有四个碳原子(无其他原子)且链节无双键高聚物的单体为两种,在正中央画线断开,然后两个半键闭合即可.
如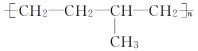 的单体为CH3—CH===CH2和CH2===CH2.
的单体为CH3—CH===CH2和CH2===CH2.
3.链节主链中只有碳原子且存在碳碳双键结构的高聚物,其规律是:“凡双键,四个碳;无双键,两个碳.”画线断开,然后将两个半键闭合,即单双键互换.
如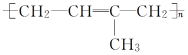 的单体是
的单体是
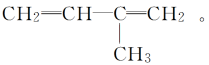
【学习小结】

 第4课时
第4课时
【学习目标】
1.能识别常见的塑料、橡胶、纤维制品,知道它们在生产和生活中的重要应用.
2.能举例说明生活中常用塑料、橡胶、纤维的化学成分及性能,知道它们的使用对人类生活质量和环境质量的影响.
【学习重难点】
重点:能识别常见的塑料、橡胶、纤维制品,知道它们在生产和生活中的重要应用.
难点:能识别常见的塑料、橡胶、纤维制品,知道它们在生产和生活中的重要应用.
【学习过程】
【新知导学】
一、塑料
1.塑料的成分
塑料的主要成分是被称为合成树脂的有机高分子化合物.在塑料的组成中,还有根据需要加入的具有某些特定用途的添加剂,如能提高塑造性能的增塑剂,防止塑料老化的防老剂等.
2.代表物——聚乙烯
(1)聚乙烯是当今世界上产量最大的塑料产品.聚乙烯是以石油化工产品——乙烯为原料,在适宜的温度、压强和引发剂存在的条件下发生反应而制得的.其化学方程式是nCH2===CH2引发剂CH2—CH2.
(2)聚乙烯塑料无臭、无毒;具有优良的耐低温性能;化学稳定性好,能耐大多数酸、碱的侵蚀;常温下不溶于一般溶剂,吸水性小;电绝缘性能优良.
(3)聚乙烯塑料品种多,应用广泛,可用于制造包装、容器、渔网绳索等多种物质.
3.其他常见塑料
合成树脂种类很多,除聚乙烯外,还有聚氯乙烯、聚苯乙烯、聚四氟乙烯等,生成它们的化学方程式为
(1)聚氯乙烯: ;
;
(2)聚苯乙烯: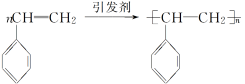 ;
;
(3)聚四氟乙烯:nCF2===CF2引发剂CF2CF2.
4.危害及防治
(1)危害:大量塑料垃圾导致白色污染,还会造成其他环境问题.
(2)为保护生存环境,采取的防治措施有①回收旧塑料;②开发可降解塑料.
【归纳总结】
塑料防老剂:防止塑料老化
【活学活用】
1.聚氯乙烯简称PVC,是当今世界上产量最大、应用最广泛的热塑性塑料之一.下列关于聚氯乙烯的说法正确的是( )
A.聚氯乙烯是CH2===CHCl发生加成聚合反应得来的
B.聚氯乙烯的性质和氯乙烯的性质相同
C.聚氯乙烯是高分子化合物,属于纯净物
D.聚氯乙烯能够使溴的四氯化碳溶液退色
答案:A
解析:聚氯乙烯的单体是CH2===CHCl,A项正确;聚氯乙烯中不含![]() ,与氯乙烯性质不同,B、D项错误;高分子化合物属于混合物,C项错误.
,与氯乙烯性质不同,B、D项错误;高分子化合物属于混合物,C项错误.
易错警示:聚氯烯不含![]() ,氯乙烯含
,氯乙烯含![]() ,二者化学性质不同.
,二者化学性质不同.
2.保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等.下列有关叙述不正确的是( )
A.PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于酒精
B.PVC的单体可由PE的单体与氯化氢加成制得
C.鉴别PE和PVC,可把其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则是PVC;如果试纸不变红,则为PE
D.等质量的聚乙烯和乙烯燃烧消耗的氧气相等
答案:B
解析:A项,PVC保鲜膜属于链状聚合物,具有热塑性,在高温时易熔化,能溶于酒精,正确;B项,PVC单体(氯乙烯)不能由PE的单体(乙烯)与氯化氢加成制得,两者反应生成氯乙烷,错误;C项,鉴别PE和PVC,可把其放入试管中加热,在试管口放置一湿润的蓝色石蕊试纸,如果试纸变红,则是PVC(分解产生HCl),如果试纸不变红,则为PE,正确;D项,等质量的聚乙烯和乙烯燃烧消耗的氧气相等,正确.
易错警示:聚乙烯、聚丙烯无毒,可用聚乙烯袋包装食品;聚氯乙烯不能用于包装食品.
二、橡胶
1.橡胶的特性
橡胶是具有高弹性的高分子化合物,其分子结构中的高分子链在无外力作用时呈卷曲状,有柔性,受外力时可伸直,取消外力后可恢复原状.
2.橡胶的分类
【归纳总结】
橡胶是一种有机高分子化合物,具有良好的弹性,但强度较差.为了增强某些橡胶制品的强度,加工时往往需进行硫化处理(即将橡胶原料与硫黄在一定条件下反应);橡胶制品硫化程度越高,强度越大,弹性越差.
【活学活用】
3.下列关于天然橡胶(![]() )的叙述中,不正确的是( )
)的叙述中,不正确的是( )
A.天然橡胶是天然高分子化合物
B.天然橡胶受空气、日光作用,会被还原而老化
C.天然橡胶能溶于汽油、苯等有机溶剂
D.天然橡胶含有双键,能发生加成反应
答案:B
解析:天然橡胶的结构单元中含有![]() ,受空气、日光作用,会逐渐被氧化而老化.
,受空气、日光作用,会逐渐被氧化而老化.
规律总结:天然橡胶的单体是![]() ,天然橡胶中含
,天然橡胶中含![]() ,具有
,具有![]() 的性质.
的性质.
4.橡胶是一种重要的战略物资,一般分为天然橡胶和合成橡胶两类.丁苯橡胶是合成橡胶的一种,其结构简式为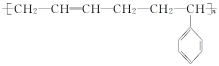 ,对于它的说法正确的是( )
,对于它的说法正确的是( )
A.合成丁苯橡胶的小分子是![]()
B.丁苯橡胶的分子式可以表示为C12nH14n,该物质为纯净物
C.装液溴或溴水的试剂瓶可用丁苯橡胶作瓶塞
D.丁苯橡胶会老化
答案:D
解析:丁苯橡胶是1,3丁二烯(CH2===CH—CH===CH2)和苯乙烯(![]() )发生加聚反应得到的,A项错误;丁苯橡胶的分子式可以表示为C12nH14n,但由于n值不确定,故该物质为混合物,B项错误;由于丁苯橡胶的结构单元中含有碳碳双键,故能与溴发生加成反应,因此装液溴或溴水的试剂瓶不能用丁苯橡胶作瓶塞,C项错误;丁苯橡胶受氧气、臭氧、日光的作用,特别是高能辐射的作用,很容易老化,D项正确.
)发生加聚反应得到的,A项错误;丁苯橡胶的分子式可以表示为C12nH14n,但由于n值不确定,故该物质为混合物,B项错误;由于丁苯橡胶的结构单元中含有碳碳双键,故能与溴发生加成反应,因此装液溴或溴水的试剂瓶不能用丁苯橡胶作瓶塞,C项错误;丁苯橡胶受氧气、臭氧、日光的作用,特别是高能辐射的作用,很容易老化,D项正确.
三、纤维
1.纤维的分类
纤维合成纤维:锦纶、腈纶
2.腈纶:聚丙烯腈纤维的商品名称为腈纶,俗称为人造羊毛.它是用石油裂解气中的丙烯制得丙烯腈再聚合而得,反应的化学方程式为 .
.
【归纳总结】
人造纤维和合成纤维的主要差别
(1)人造纤维是用木材草类的纤维经化学加工制成的黏胶纤维或醋酸纤维.
(2)合成纤维是用石油、天然气、煤和农副产品作原料制成单体,再经聚合反应制成的纤维.
【活学活用】
5.某质检员将甲、乙、丙三种衣料做纤维检验,所得结果如下表:
甲 | 乙 | 丙 | |
靠近火焰 | 稍微卷缩 | 无变化 | 尖端熔成小球 |
燃烧的气味 | 有特殊气味 | 无异味 | 有味 |
热塑性 | 无 | 无 | 良好 |
检验甲、乙、丙三种衣料纤维后得出的最佳结论是( )
A.甲为棉,乙为丝,丙为涤纶
B.甲为丝,乙为棉,丙为腈纶
C.甲为腈纶,乙为丝,丙为棉
D.甲为棉,乙为维尼纶,丙为丝
答案:B
解析:棉的主要成分为纤维素,燃烧时无异味,乙为棉.丝的主要成分为蛋白质,燃烧时有特殊气味,甲为丝.涤纶、腈纶、维尼纶等都是合成纤维.
易错警示:纤维的成分不一定是纤维素,也可能是蛋白质等.
【学习小结】